题目内容
16.下列叙述正确的是( )| A. | H2 和D2 互为同位素 | |
| B. | 40Ca和40K中质子数和中子数都不相等 | |
| C. | 只含一种元素的物质一定是纯净物 | |
| D. | 18O中中子数和质子数相等 |
分析 A、质子数相同中子数不同的原子互称同位素,互为同位素原子具有以下特征:质子数相同、中子数不同,研究对象为原子;
B、根据质子数+中子数=质量数来分析;
C、氧气与臭氧的混合物中只含有一种元素;
D、中子数=质量数-质子数,据此解答即可.
解答 解:A、H2和D2均是H元素形成得到单质,属于同种物质,不是同位素,故A错误;
B、40K的质子数为19,中子数为40-19=21,40Ca的质子数与中子数都是20,故B正确;
C、某物质只含一种元素,该物质不一定是纯净物,如氧气与臭氧的混合物中只含有一种元素,故C错误;
D、O元素的质子数为8,中子数=18-8=10,故两者不同,故D错误,
故选B.
点评 本题考查原子的构成、同位素、同素异形体、纯净物、混合物等,注重基础知识的考查,较简单.

练习册系列答案
相关题目
7.下列措施中,能减慢化学反应速率的是( )
| A. | 将块状固体药品研细后再反应 | |
| B. | 将H2O2溶液存放在低温冷暗处 | |
| C. | 用FeCl3溶液作H2O2分解反应的催化剂 | |
| D. | 用2 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应 |
4.能在溶液中大量共存的一组离子是( )
| A. | NH4+、Ag+、CO32-、Cl- | B. | Fe3+、H+、I-、HCO3- | ||
| C. | K+、Na+、NO3-、Cl- | D. | H+、Fe2+、SO42-、NO3- |
1.在体积不变的容器中发生反应:2HI(g)?H2(g)+I2(g),下列叙述中可以说明反应已达平衡状态的是( )
①一个H-H键断裂的同时有两个H-I键断裂;②HI浓度等于I2浓度;③反应速率v正(H2)=v逆(HI);④HI、H2、I2分子数之比为2:1:1;⑤容器内压强不变;⑥容器内气体颜色不再变化.
①一个H-H键断裂的同时有两个H-I键断裂;②HI浓度等于I2浓度;③反应速率v正(H2)=v逆(HI);④HI、H2、I2分子数之比为2:1:1;⑤容器内压强不变;⑥容器内气体颜色不再变化.
| A. | ①③⑤ | B. | ②⑥ | C. | ④⑤ | D. | ①⑥ |
8.下列叙述中正确的是( )
| A. | 金属晶体的熔点和沸点都很高 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
6.(1)现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质,判断能设计成原电池的反应是B(填序号).
(2)选择适宜的材料和试剂将(1)中你的选择设计为一个原电池.
①在图1的方框中画出装置图并说明电解质溶液.②写出电极反应式.
(3)氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,是一种具有应用前景的绿色电源.图2为氢氧燃料电池原理示意图,按照此图的提示回答下列问题:
①该燃料电池的负极是a(写a或b).
②O2 (写化学式)发生还原反应.
③燃料电池中是将化学能转化为电能,总反应式是2H2+O2=2H2O.
(4)锌锰干电池是最早使用的化学电池,其基本构造如图3所示.锌锰干电池的负极是锌,电路中每通过0.4mole-,负极质量减少13g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-=2NH3↑+H2↑.
(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
①根据两反应本质,判断能设计成原电池的反应是B(填序号).
(2)选择适宜的材料和试剂将(1)中你的选择设计为一个原电池.
①在图1的方框中画出装置图并说明电解质溶液.②写出电极反应式.
| 电极 | 电极材料 | 电极反应式 |
| 负极 | ||
| 正极 |

①该燃料电池的负极是a(写a或b).
②O2 (写化学式)发生还原反应.
③燃料电池中是将化学能转化为电能,总反应式是2H2+O2=2H2O.
(4)锌锰干电池是最早使用的化学电池,其基本构造如图3所示.锌锰干电池的负极是锌,电路中每通过0.4mole-,负极质量减少13g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-=2NH3↑+H2↑.

 ;
; .
.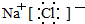 .
. 