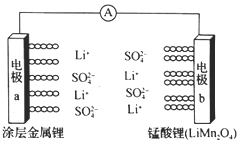
题目内容
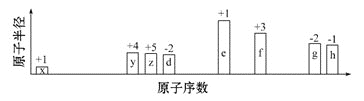
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中位置,用化学用语回答下列问题:
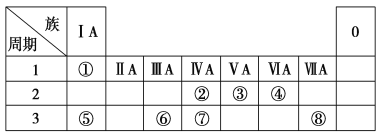
(1)④、⑤、⑥的原子半径由大到小的顺序是________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种具有漂白性的化合物的电子式:________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.KMnO4 c.Na2SO3 d.Fe2(SO4)3
(5)用电子式表示①与③组成的最简单的化合物的形成过程:_________________ 。
【答案】Na>Al>O HNO3>H2CO3>H2SiO3 ![]() ad
ad 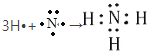
【解析】
①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl。
⑴原子半径从左到右依次减小,从上到下依次递减,得到半径大小关系。
⑵非金属性越强,其最高价含氧酸的酸性越强,得到酸性强弱顺序。
⑶具有漂白性的化合物为次氯酸钠,再书写电子式。
⑷由表中两种元素的原子按1∶1组成的常见液态化合物为过氧化氢,一般是二氧化锰和铁离子起催化作用。
⑸氨气是三个氢原子和一个氮原子形成,再书写电子形成过程。
⑴原子半径从左到右依次减小,从上到下依次递减,因此④、⑤、⑥的原子半径由大到小的顺序是Na>Al>O,故答案为:Na>Al>O。
⑵非金属性越强,其最高价含氧酸的酸性越强,因此②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3。
⑶①H、④O、⑤Na、⑧Cl中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种具有漂白性的化合物为次氯酸钠,其电子式:![]() ,故答案为:
,故答案为:![]() 。
。
⑷由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,则为过氧化氢,一般二氧化锰和铁离子其催化作用,故答案为:ad。
⑸氨气是三个氢原子和一个氮原子形成,用电子式表示①与③组成的最简单的化合物的形成过程: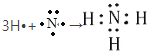 ,故答案为:
,故答案为: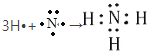 。
。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案