题目内容
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
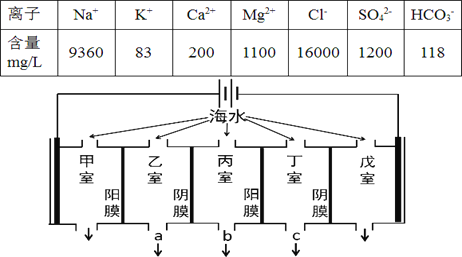
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
【答案】D
【解析】
A. 由图可知,甲室电极与电源正极相连,为阳极室,Cl-放电能力大于OH-,所以阳极的电极反应式为:2Cl--2e-= Cl2↑,故A正确;
B. 由图可知,戊室电极与电源负极相连,为阴极室,开始电解时,阴极上水得电子生成氢气同时生成OH-,生成的OH-和HCO3-反应生成CO32-,Ca2+转化为CaCO3沉淀,OH-和Mg2+生成Mg(OH)2,CaCO3和Mg(OH)2是水垢的成分,故B正确;
C. 阳膜只允许阳离子通过,阴膜只允许阴离子通过,电解时丙室中阴离子移向乙室,阳离子移向丁室,所以丙室中物质主要是水,则淡水的出口为b出口,故C正确;
D.根据B项的分析,戊室收集到的是H2,当戊室收集到22.4L(标准状况)气体时,则电路中转移2mol电子,通过甲室阳膜的离子为阳离子,既有+1价的离子,又有+2价的离子,所以物质的量不是2mol,故D错误。
故选D。

【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO3- >I2 |
B | 淀粉溶液在硫酸存在下加热一段时间后,再与新制的Cu(OH)2悬浊液混合,加热煮沸 | 无红色沉淀生成 | 淀粉没有水解 |
C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数:Kh(CH3COO-)<Kh(HCO3-) |
D | 常温时,用两支试管各取5 mL 0.1 mol/L 酸性KMnO4溶液,分别加入0.1 mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2 mol/L H2C2O4溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
A. A B. B C. C D. D

