题目内容
【题目】下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
元素符号 | Sc | Ti | V | Cr | Mn |
核电荷数 | 21 | 22 | 23 | 24 | 25 |
最高正价 | +3 | +4 | +5 | +6 | +7 |
(1) 按要求完成填充:
①Sc的价电子排布___________________________________________________________ ;
②Ti外围电子排布____________________________________________________________;
③用“原子实”表示V的核外电子排布___________________________________________;
④ 用轨道表示式表示Mn的特征电子排布 _______________________________________。
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是_________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是_____出现这一现象的原因是________________________________________________________。
【答案】Sc: 3d14s2 Ti: 3d24s2 V: [Ar]3d34s2 Mn: ![]() 尊重客观事实,注重理论适用范围,掌握特例 五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和 能量交错使得d电子也参与了化学反应
尊重客观事实,注重理论适用范围,掌握特例 五种元素的最高正化合价数值等于各元素基态原子的最高能层s电子和次高能层d电子数目之和 能量交错使得d电子也参与了化学反应
【解析】
(1)根据能量最低原理、泡利不相容原理、和洪特定则等可以写出核外电子排布;
(2) 碰到客观事实与理论不相吻合的问题,要尊重客观事实,注重理论适用范围,掌握特例;
(3)对比表格数据可以观察出现象和原因。
(1) ①Sc是第21号元素,位于第四周期,有四个电子层,最外层有3个电子,因为第4层的s轨道的能量比第3层的d轨道低,所以电子先排第4层s轨道的两个位置,再排第3层d轨道的一个位置,Sc的价电子排布为:3d14s2;
②Ti是第22号元素,位于第四周期,有四个电子层,最外层有4个电子,因为第4层的s轨道的能量比第3层的d轨道低,所以电子先排第4层s轨道的两个位置,再排第3层d轨道的2个位置,Ti的价电子排布为:3d24s2;
③V是第23号元素,位于第四周期,有四个电子层,最外层有5个电子,因为第4层的s轨道的能量比第3层的d轨道低,所以电子先排第4层s轨道的两个位置,再排第3层d轨道的3个位置,V的价电子排布为:3d34s2,用“原子实”表示V的核外电子排布为:[Ar]3d34s2;
④Mn是第24号元素,位于第四周期,有四个电子层,最外层有7个电子,因为第4层的s轨道的能量比第3层的d轨道低,所以电子先排第4层s轨道的两个位置,剩余5个电子再排第3层d轨道的5个位置,用轨道表示式表示Mn的特征电子排布为:![]() ;
;
(2) 已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当遇到这样的问题时,态度应该是: 尊重客观事实,注重理论适用范围,掌握特例;
(3)对比这五种元素原子的核外电子排布与元素的最高正化合价,可以发现五种元素的最高正化合价数值等于各元素基态原子的最外层s电子和次外层d电子数目之和,出现这一现象的原因是能级交错使d电子也参与了化学反应。

【题目】下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
a | |||||||||||||||||
f | h | i | |||||||||||||||
b | e | j | |||||||||||||||
c | d | g | k | ||||||||||||||
l | |||||||||||||||||
(1)请写出d元素的原子结构示意简图:___________________________________;
(2)请写出i的单质与a、h形成的化合物发生反应的化学方程式_______________________;
(3)请写出上述元素组成的物质间发生的与“(2)”反应类型相同且有固体非金属单质生成的化学反应方程式________________________________________________;
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出g元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式:______________________________________________________;
(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出j、k的互化物与c、l形成的化合物等物质的量反应时的化学方程式________________。
(6)用电子式表示c、h两种元素以原子个数比1:1形成化合物的形成过程:______________________________________________________。
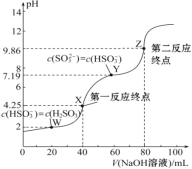
【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1______K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
a .容器内N2,H2,NH3的浓度之比为1:3:2 b. υ(N2)正=3υ(H2)逆
c .容器内压强保持不变 d. 混合气体的密度保持不变
③在400℃时,当测得NH3和N2,H2的物质的量分别为1mol和2mol,3mol时,则该反应的υ(N2)正______υ(N2)逆(填写“>,“=”或“<”)。