题目内容
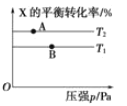
【题目】有相对原子质量均大于10的A、B两种元素,原子核内质子数等于中子数。它们能形成气态化合物X和Y。已知等物质的量的X和Y的混合物的密度是同条件下氢气密度的18.5倍,其中X和Y的质量比为3:4.4,经测定X的组成为AB,Y的组成为AnB,试通过计算确定:A、B各是什么元素______________?写出X、Y的化学式______________。
【答案】A、B应分别为N元素和O元素 X、Y分别为NO和N2O
【解析】
根据气体阿伏伽德罗定律的推论可知已知等物质的量的X和Y的混合物的相对分子质量是18.5×2=37,已知X与Y的质量比为可以推知X与Y的相对分子质量之比,解方程可得答案。
由等物质的量的X和Y混合的气体其密度是相同条件下氢气的18.5倍可知x,y混合气体的相对分子量为18.5×2=37;等物质的量的X和Y的混合物中,X与Y的质量比为3:4.4 ,由M=![]() 可知相对分子质量之比为3:4.4,又因为等物质量X和Y混合气体的平均相对分子量为37,所以X和Y的相对分子质量之和为37×2=74,可以知道X的分子量为30, y的分子量为44,由A+B=30 A×n+ B=44可知(n-1)×A=14,且n和A为整数,所以得到n=2;A=14;B=16。所以A为7号原子,B为8号原子,即A是N, B是O ,X是NO ,Y是N2O。故答案为:A、B应分别为N元素和O元素;X、Y分别为NO和N2O。
可知相对分子质量之比为3:4.4,又因为等物质量X和Y混合气体的平均相对分子量为37,所以X和Y的相对分子质量之和为37×2=74,可以知道X的分子量为30, y的分子量为44,由A+B=30 A×n+ B=44可知(n-1)×A=14,且n和A为整数,所以得到n=2;A=14;B=16。所以A为7号原子,B为8号原子,即A是N, B是O ,X是NO ,Y是N2O。故答案为:A、B应分别为N元素和O元素;X、Y分别为NO和N2O。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
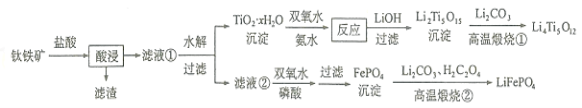
回答下列问题:
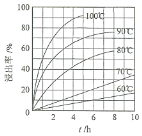
(1) “酸浸”实验中,铁的浸出率结果如图所示。由图可知:当铁的浸出率为70%时,所采用的实验条件为____________________。
(2) “酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率 | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_____________________。
(4)Li2Ti5O15中Ti的化合价为![]() ,其中过氧键的数目为______________。
,其中过氧键的数目为______________。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_______________。
【题目】下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
元素符号 | Sc | Ti | V | Cr | Mn |
核电荷数 | 21 | 22 | 23 | 24 | 25 |
最高正价 | +3 | +4 | +5 | +6 | +7 |
(1) 按要求完成填充:
①Sc的价电子排布___________________________________________________________ ;
②Ti外围电子排布____________________________________________________________;
③用“原子实”表示V的核外电子排布___________________________________________;
④ 用轨道表示式表示Mn的特征电子排布 _______________________________________。
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是_________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是_____出现这一现象的原因是________________________________________________________。