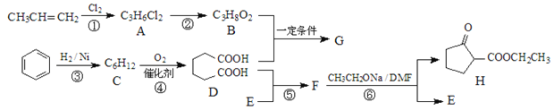
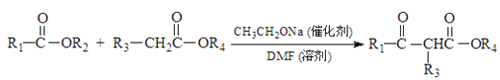
��Ŀ����
����Ŀ�����ǵ����Ϻ�����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺��ͼ���漰����Ϊ��̬��

��1����ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ______��
��2����0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��N2��g��+3H2��g��![]() 2NH3��g����H��0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2NH3��g����H��0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t/�� | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1______K2����д����������=��������������
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_______���������ĸ����
a .������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b. ����N2����=3����H2����
c .������ѹǿ���ֲ��� d. ���������ܶȱ��ֲ���
����400��ʱ�������NH3��N2��H2�����ʵ����ֱ�Ϊ1mol��2mol��3molʱ����÷�Ӧ������N2����______����N2��������д��������=��������������
���𰸡�NO2��g��+CO��g��=CO2��g��+NO��g����H=��234kJ/mol�� �٣� c ��
��������
��1������1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����Ӧ�ʱ�=134kJ/mol��368kJ/mol=��234kJ/mol����Ӧ���Ȼ�ѧ����ʽΪNO2��g��+CO��g��=CO2��g��+NO��g����H=��234kJ/mol��
��2���ٸ÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���������Ũ�ȼ�С����Ӧ��Ũ����������K1��K2��
��N2��g��+3H2��g��![]() 2NH3��g����H��0����Ӧ�����������С�ķ��ȷ�Ӧ����
2NH3��g����H��0����Ӧ�����������С�ķ��ȷ�Ӧ����
a�������ڸ����ʵ�Ũ��֮�ȵ��ڼ�����֮�ȣ�����֤�����淴Ӧ������ȣ�����˵����Ӧ�ﵽƽ��״̬��
b����ͬ���ʵ����淴Ӧ����֮�ȵ����������֮����ƽ��״̬��3����N2����=����H2������ƽ��״̬������N2����=3����H2������Ӧû�дﵽƽ��״̬��
c��������ѹǿ���䣬��������ʵ������䣬�÷�Ӧ��ƽ��״̬��
d����������ܱ������з�Ӧ���������䣬������䣬�ܶ�ʼ�ղ��䣬��������ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬��
��ѡc��
��400��ʱ����0.5L�����У�NH3��N2��H2�����ʵ���Ũ�ȷֱ�Ϊ��2mol/L��4mol/L��6mol/L��400��ʱ��Ũ����Qc=![]() =0.0046��K=0.5��˵����Ӧ������У����������N2����������N2������
=0.0046��K=0.5��˵����Ӧ������У����������N2����������N2������

 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д�����Ŀ����.ijѧϰС���á���ӵ��������ⶨ����CuCl2��2H2O�������������������I-������Ӧ�������������ʣ��Ĵ��ȣ��������£�ȡ0.800g ��������ˮ���������KI ���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3 ����Һ�ζ�������ζ��յ�ʱ��ƽ������Na2S2O3 ����Һ40.00 mL������֪��2Cu2++4I-=2CuI��+I2��I2+2S2O32-=S4O62-+2I-����
��1����ѡ��________���ζ�ָʾ�����ζ��յ��������________________��
��2����������CuCl2��2H2O �������ٷ���Ϊ________________��
��.25�棬������ĵ���ƽ�ⳣ���������Ҫ��ش��������⡣
K1 | K2 | |
H2SO3 | 1.3��10-2 | 6.3��10-8 |
H2CO3 | 4.2��10-7 | 5.6��10-11 |
��1�������ӷ���ʽ��ʾ����������Һ�ʼ��Ե�ԭ��________________________________��
��2��Ũ�Ⱦ�Ϊ0.1mol/L��Na2SO3��Na2CO3����Һ��SO32-��CO32-��HSO3-��HCO3-Ũ�ȴӴ�С��˳��Ϊ________________________________��
��3������������Һ��ͨ������CO2����Ļ�ѧ����ʽ________________________________��