题目内容
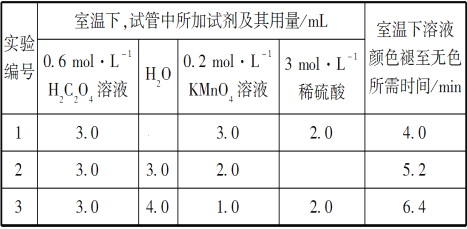
【题目】常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如下图。下列说法正确的是

A. 曲线I和曲线II分别代表的是CH3COOH和HCN
B. 点①和点②所示溶液中: ![]()
C. 点③和点⑤所示溶液中由水电离出的c(H+):⑤>③
D. 在点②和③之间(不包括端点)存在关系:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
【答案】B
【解析】A项,CH3COOH的Ka大于HCN的Ka,物质的量浓度都是0.1mol/L的CH3COOH溶液的pH小于HCN,曲线I代表的是HCN,曲线II代表的是CH3COOH,错误;B项,点①和点②表示加入10mLNaOH溶液,此时点①中的物料守恒为c(HCN)+c(CN-)=2c(Na+),点②中的物料守恒为c(CH3COOH)+c(CH3COO-)=2c(Na+),由于两溶液中c(Na+)相等,则c(HCN)+c(CN-)= c(CH3COOH)+c(CH3COO-),即c(CH3COO-)- c(CN-)= c(HCN)- c(CH3COOH),正确;C项,点③溶液由CH3COONa和CH3COOH混合而成,点⑤溶液由NaCN和HCN混合而成,点③和点⑤溶液中的OH-全部来自水电离,点③和点⑤溶液的pH都等于7,点③和点⑤溶液中水的电离程度相等,错误;D项,NaOH溶液滴定CH3COOH溶液的过程中,溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),点②和点③之间溶液呈酸性,c(H+)![]() c(OH-),则c(Na+)
c(OH-),则c(Na+)![]() c(CH3COO-),错误;答案选B。
c(CH3COO-),错误;答案选B。

【题目】下列有关实验操作、现象和结论都正确的是( )
实验操作 | 现象和结论 | |
A | 在平衡3KSCN + FeCl3 | 溶液红色变浅,平衡逆向移动 |
B | 向AgI沉淀中滴入KCl溶液 | 有白色沉生成,Ksp(AgCl)<Ksp(AgI) |
C | 把Cl2通入品红溶液中 | 溶液褪色,Cl2具有漂白性 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色,氧化性:H2O2> Fe3+ |
A.A
B.B
C.C
D.D