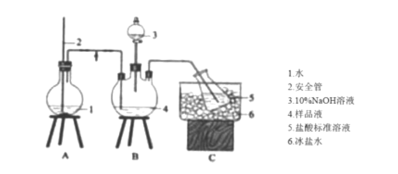
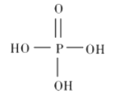
题目内容
【题目】下列实验事实能说明HNO2是弱电解质的是
①HNO2溶液与NaHCO3溶液混合,放出气泡
②用HNO2溶液做导电性实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1mol·L -1HNO2溶液中,c(H+)=0.015mol·L-1
⑤相同浓度时,HNO2溶液的导电能力比盐酸弱
⑥取0.1mol·L -1HNO2溶液200mL,加水至体积为2L,pH>2
A.①②③B.④⑤⑥C.①③④D.①④⑤⑥
【答案】B
【解析】
①HNO2溶液 与NaHCO3溶液混合,放出气泡,只能说明HNO2具有酸性,不能判断HNO2是否属于弱电解质,故不符合题意;
②用HNO2溶液做导电性实验,灯泡很暗,只能说明溶液中可移动离子浓度较低,因不确定HNO2的浓度,因此无法判断HNO2是否属于弱电解质,故不符合题意;
③HNO2溶液不与Na2SO4溶液反应,只能说明二者能够大量共存,无法判断HNO2是否属于弱电解质,故不符合题意;
④0.1mol·L -1HNO2溶液中,c(H+)=0.015mol·L-1,说明HNO2未发生完全电离,可说明HNO2属于弱电解质,故符合题意;
⑤HNO2和盐酸二者均为一元酸,相同浓度时,HNO2溶液导电能力弱说明HNO2在溶液中未发生完全电离,可说明HNO2属于弱电解质,故符合题意;
⑥取0.1mol·L -1HNO2溶液200mL,加水至体积为2L,稀释后的HNO2浓度为![]() ,此时溶液pH>2,说明HNO2在溶液中未发生完全电离,可说明HNO2属于弱电解质,故符合题意;
,此时溶液pH>2,说明HNO2在溶液中未发生完全电离,可说明HNO2属于弱电解质,故符合题意;
故答案为:B。

【题目】苯甲酸乙酯稍有水果气味,用于配制香水香精和人造精油,也大量用于食品中,实验室制备方法如下:
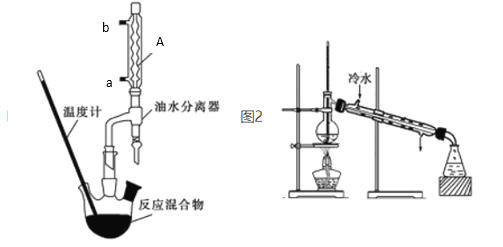
Ⅰ苯甲酸乙酯粗产品的制备
在干燥的50 mL三颈圆底烧瓶中,加入6.1g苯甲酸、过量无水乙醇、8 mL苯和1mL浓硫酸,摇匀后加沸石,安装分水器。水浴加热,开始控制回流速度1~2 d/s。反应时苯一乙醇﹣水会形成“共沸物”蒸馏出来。加热回流约1小时,至分水器中不再有小水珠生成时,停止加热。改为蒸馏装置,蒸出过量乙醇和苯。
沸点(℃) | 相对分子质量 | |
苯甲酸 | 249 | 122 |
苯甲酸乙酯 | 212.6 | 150 |
(1)写出苯甲酸与用18O标记的乙醇酯化反应的方程式___________________。
(2)装置A的名称及冷水通入口_________________________。
(3)通过分水器不断分离除去反应生成的水,目的是___________________。还有什么方法可以实现同样的目的_____________(任答两种)。
(4)实验过程中没有加沸石,请写出补加沸石的操作___________________。
(5)图二装置中的错误______________________。
Ⅱ.苯甲酸乙酯的精制
将苯甲酸乙酯粗产品用如下方法进行精制:将烧瓶中的液体倒入盛有30 mL冷水的烧杯中,搅拌下分批加入饱和Na2CO3溶液(或研细的粉末),至无气体产生,pH试纸检测下层溶液呈中性。用分液漏斗分出粗产物,水层用乙醚(10 mL)萃取。合并有机相,用无水CaCl2干燥。干燥后的粗产物先用水浴蒸除乙醚,再改用减压蒸馏,收集馏分。
(6)加入饱和碳酸钠溶液除了可以降低苯甲酸乙酯溶解度外,还有的作用是__________。
(7)按照纠正后的操作进行,测得产品体积为5mL(苯甲酸乙酯密度为1.05gcm﹣3)。实验的产率为_________。
【题目】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
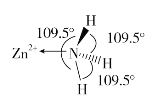
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________。
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
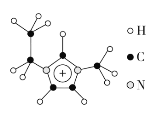
大π键可用符号Π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________。
(5)Zn与S形成某种化合物的晶胞如图所示。
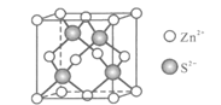
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。