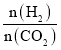题目内容
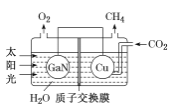
【题目】锌、氮元素形成的化合物在各领域有着重要的作用。
(1)基态Zn2+的价电子排布式为_______________;
(2)独立的NH3分子中,H-N-H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H-N-H键键角。
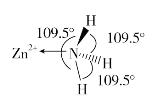
请解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是_____________。
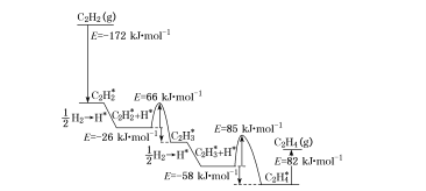
(3)离子液体具有很高的应用价值,其中EMIM+离子由H、C、N三种元素组成,其结构如图所示:
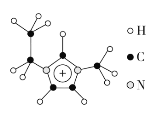
大π键可用符号Π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
表示,其中m、n分别代表参与形成大π键的原子数和电子数。则EMIM+离子中的大π键应表示为___________________。化合物[EMIM][AlCl4]具有很高的应用价值,其熔点只有7 ℃,该物质晶体的类型是________。
(4)过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律,已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:____________________。
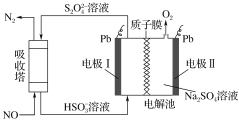
(5)Zn与S形成某种化合物的晶胞如图所示。
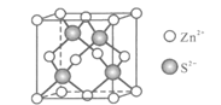
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2-、Zn2+相切?_________(填“能”或“否”);已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
【答案】3d10 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成键电子对之间的排斥作用,排斥作用减弱,所以H-N-H键键角变大 Π![]() 离子晶体 3d轨道上没有未成对电子(或3d轨道为全空或全满状态) 正四面体 否
离子晶体 3d轨道上没有未成对电子(或3d轨道为全空或全满状态) 正四面体 否  ×1010-a
×1010-a
【解析】
(1)基态Zn的电子排布式为1s22s22p63s23p63d104s2,由此可确定Zn2+的价电子排布式。
(2)解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°,可从电子对的排斥作用寻找原因。
(3)EMIM+离子中形成大π键的原子有5个,其中3个C原子、2个N原子,参与形成大π键的电子数为6。化合物[EMIM][AlCl4],由[EMIM]+、[AlCl4]-构成,由此可确定该物质的晶体类型。
(4)通过对Sc3+、Cr3+、Fe2+、Zn2+四种离子的核外电子进行分析,得出Sc3+、Zn2+的水合离子为无色的原因。
(5)①四个S2-构成正四面体结构,Zn2+体积很小,填入S2-组成的空隙中;
②由①无法判断出S2-、Zn2+是否相切;已知晶体密度为dg/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,可通过建立一个正四面体,确定一个三角形,计算Zn2+半径。
(1) 基态Zn的电子排布式为1s22s22p63s23p63d104s2,则基态Zn2+的价电子排布式为3d10。答案为:3d10;
(2)在独立的NH3分子中,N原子的孤电子对排斥成键电子对的能力强,[Zn(NH3)6]2+中,N原子的孤电子对转化为成键电子对,对其它三个成键电子对的排斥作用减弱,键角增大。
从而得出解释[Zn(NH3)6]2+离子中H-N-H键角变为109.5°的原因是氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成键电子对之间的排斥作用,排斥作用减弱,所以H-N-H键键角变大。答案为:氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成键电子对之间的排斥作用,排斥作用减弱,所以H-N-H键键角变大;
(3) EMIM+离子中形成大π键的原子有5个,其中3个C原子、2个N原子,参与形成大π键的电子数为6,EMIM+离子中的大π键应表示为Π![]() 。化合物[EMIM][AlCl4],由[EMIM]+、[AlCl4]-构成,则晶体类型为离子晶体。答案为:Π
。化合物[EMIM][AlCl4],由[EMIM]+、[AlCl4]-构成,则晶体类型为离子晶体。答案为:Π![]() ;离子晶体;
;离子晶体;
(4)通过对Sc3+、Cr3+、Fe2+、Zn2+四种离子的核外电子进行分析发现,得出Sc3+、Zn2+的电子排布式为1s22s22p63s23p6、1s22s22p63s23p63d10,3d轨道为全空和全满,而另两种离子,3d轨道都存在未成对电子,由此得出水合离子为无色的原因是3d轨道上没有未成对电子(或3d轨道为全空或全满状态)。答案为:3d轨道上没有未成对电子(或3d轨道为全空或全满状态);
(5)①四个S2-构成正四面体结构,Zn2+体积很小,填入S2-组成的正四面体空隙中;答案为:正四面体;
②由①分析,我们不能得出S2-、Zn2+是否相切。

由晶胞结构我们可以得出:晶胞中含S2-的个数为4,含Zn2+的个数为8×![]() +6×
+6×![]() =4,所以晶体的体积为
=4,所以晶体的体积为![]() =
=![]() cm3,晶胞边长为
cm3,晶胞边长为 cm。
cm。
四个Zn2+在体内四个小正四面体的中心,不在同一平面内,过b点向上面作垂线,构成三角形,两边分别为![]() x、
x、![]() x,即可求出斜边为
x,即可求出斜边为![]() x(x为晶胞边长),则a位置S2-离子与b位置Zn2+之间的距离为
x(x为晶胞边长),则a位置S2-离子与b位置Zn2+之间的距离为![]() x,从而得出 a+r(Zn2+)=
x,从而得出 a+r(Zn2+)=![]()
 ×1010pm,r(Zn2+)=(
×1010pm,r(Zn2+)=(![]()
 ×1010-a)pm。答案为:否;
×1010-a)pm。答案为:否;![]()
 ×1010-a。
×1010-a。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案