题目内容
2.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的单质能与强酸、强碱溶液反应放出氢气 |
| W | W的一种核素的质量数为28,中子数为14 |
(2)X、Y、W气态氢化物的稳定性大小顺序H2O>CH4>SiH4(用化学式表示).
(3)写出Y单质的电子式
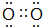 .
.(4)振荡下,向Z单质与盐酸反应后的无色溶液中逐滴滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应的化学方程式是Si+4HF=SiF4↑+2H2↑.
(5)在25℃、101kPa下,已知13.5g的Z单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
分析 X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,Y是地壳中含量最高的元素,则Y为O元素;Z的单质能与强酸、强碱溶液反应放出氢气,则Z为Al;W一种核素的质量数为28,中子数为14,质子数为28-14=14,则W为Si元素;X最高价氧化物对应的水化物化学式为H2XO3,则X为第ⅣA族元素,原子序数小于氧,则X为碳元素,据此解答.
解答 解:X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,Y是地壳中含量最高的元素,则Y为O元素;Z的单质能与强酸、强碱溶液反应放出氢气,则Z为Al;W一种核素的质量数为28,中子数为14,质子数为28-14=14,则W为Si元素;X最高价氧化物对应的水化物化学式为H2XO3,则X为第ⅣA族元素,原子序数小于氧,则X为碳元素.
(1)W为Si元素,Si原子核外有3个电子层,最外层电子数为4,处于周期表中第三周期第ⅣA族;
同主族自上而下原子半径增大,故原子半径Si>C,
故答案为:第三周期第ⅣA族;大;
(2)非金属性O>C>Si,元素的非金属性越强,气态氢化物越稳定,故氢化物稳定性:H2O>CH4>SiH4,
故答案为:H2O>CH4>SiH4;
(3)Y单质为O2,电子式为: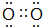 ,
,
故答案为: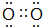 ;
;
(4)Al单质与盐酸反应后的无色溶液为氯化铝溶液,振荡下,向氯化铝溶液中滴加NaOH溶液直至过量,首先反应生成氢氧化铝,然后氢氧化铝与氢氧化钠反应生成偏铝酸钠,故能观察到的现象是:先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;
Si的单质与氢氟酸反应生成四氟化硅与氢气,反应方程式为:Si+4HF=SiF4↑+2H2↑;
故答案为:先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;Si+4HF=SiF4↑+2H2↑;
(4)13.5g的Al的物质的量为$\frac{13.5g}{27g/mol}$=0.5mol,4molAl在O2气体中完全燃烧后恢复至原状态放出的热量为419kJ×$\frac{4mol}{0.5mol}$=3352kJ,故热化学方程式为:4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol,
故答案为:4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
点评 本题考查进行性质位置关系应用,题目难度不大,正确推断元素的种类是解答本题的关键,旨在考查学生对基础知识的理解掌握.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO${\;}_{3}^{2-}$)>c(H2SO3) | |
| B. | 使酚酞呈红色的苯酚与苯酚钠混合溶液中:c(Na+)>c(C6H5O-)>c(OH-)>c(H+) | |
| C. | 在0.1 mol•L-1 Na2CO3溶液中:c(HCO${\;}_{3}^{-}$)=c(H2CO3)+c(H+)-c(OH-) | |
| D. | 等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) |
| A. | c(CH3COOH)>c(Na+) | B. | c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COOH)=c(CH3COO-)+c(H+) |
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 只含一种元素的物质,一定不是化合物,但是可能是混合物 | |
| C. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| D. | 依据CO2、SO3、SiO2为酸性氧化物,可以得出结论:酸性氧化物均为非金属氧化物 |
| A. | pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L | |
| B. | pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | pH=3的醋酸溶液加水稀释过程中:$\frac{c(O{H}^{-})}{c({H}^{+})}$逐渐增大 | |
| D. | 0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-) |
| A. |  图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 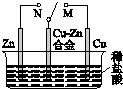 图中,开关由M改置于N时,Cu-Zn合金的腐蚀速率加快 | |
| C. | 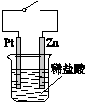 图中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 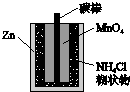 图中,Zn-MnO2干电池为一次性电池,将NH4Cl换成湿的KOH后电池性能更好 |
| A. | Mg | B. | Zn2+ | C. | Fe2+ | D. | H2 |
| A. | 类铅元素原子的最外层电子数为7 | B. | 其常见价态为+2、+4、+6 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小 |
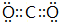 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是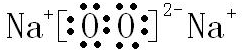 .
.