题目内容
19.下列叙述正确的是( )| A. | 合成高分子材料都难以降解,会造成环境污染 | |
| B. | 塑料、涂料和合成橡胶被称为“三大合成材料” | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 |
分析 A、部分合成高分子化合物难降解;
B、塑料、合成纤维和橡胶为三大合成材料;
C、食品包装袋、食物保鲜膜等材料的主要成份是氯乙烯,聚氯乙烯有毒;
D、高吸水性树脂属于功能高分子材料.
解答 解:A、部分合成高分子化合物难降解,如聚乙烯、聚氯乙烯等塑料制品难降解,会造成环境污染,但部分合成高分子化合物易降解,比如:绿色荧光蛋白质(GFP)是高分子化合物,可降解,故A错误;
B、塑料、合成纤维和橡胶为三大合成材料,故B错误;
C、聚氯乙烯受热易分解生成有毒物质,所以聚氯乙烯不能用来作食品包装袋、食物保鲜膜,故C错误;
D、高吸水性树脂属于功能高分子材料,故D正确,故选D.
点评 本题考查了化学与生活,综合性较强,但都较基础,注意基础知识的积累,并用化学知识解释生产、生活现象,难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 3.0g C2H6中含有共用电子对的数目为0.7×6.02×1023 | |
| B. | 25℃时pH=1的醋酸溶液中含有H+的数目为0.1×6.02×1023 | |
| C. | 已知2CO(g)+O2(g)?2CO2(g)△H=-a kg•mol-1,将2NA个CO与NA个O2混合,充分反应放出a kJ的热量 | |
| D. | 50mL 18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
10.下列有关化学研究的正确说法是( )
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 只含一种元素的物质,一定不是化合物,但是可能是混合物 | |
| C. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| D. | 依据CO2、SO3、SiO2为酸性氧化物,可以得出结论:酸性氧化物均为非金属氧化物 |
7.下列与金属腐蚀有关的说法正确的是( )
| A. |  图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 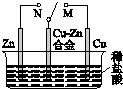 图中,开关由M改置于N时,Cu-Zn合金的腐蚀速率加快 | |
| C. | 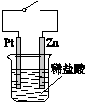 图中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 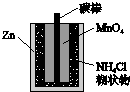 图中,Zn-MnO2干电池为一次性电池,将NH4Cl换成湿的KOH后电池性能更好 |
11.下列粒子中,既具有氧化性,又具有还原性的是( )
| A. | Mg | B. | Zn2+ | C. | Fe2+ | D. | H2 |
9. 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)$\stackrel{一定条件}{→}$CO(g)+3H2(g) I.
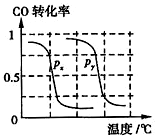
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH30H(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了右边的实验设计表中.
a.右表中剩余的实验条件数据:
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=0.1 MPa.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
(1)将1.0molCH4和2.0molH2O(g)通入反应(容积为l00L),在一定条件下发生反应:
cCH4(g)+H2O(g)$\stackrel{一定条件}{→}$CO(g)+3H2(g) I.
CH4的转化率与温度、压强的关系如图所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003mol/(L•min)
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③该反应的△H>0 (填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)$\frac{\underline{\;催化剂\;}}{\;}$ CH30H(g);△H<0Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是BD (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人lmolCO和3mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了右边的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
n=150,m=$\frac{1}{3}$.
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=0.1 MPa.
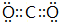 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是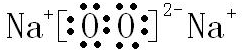 .
.