题目内容
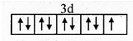
18.前四周期原子序数依次增大的元素A、B、C、D中,A、B、C均处于第二周期且价电子层中未成对电子数分别为2、3、2:D为ds区元素且最外电子层上只排布了2个电子.回答下列问题:(1)D2+的价层电子排布图为
 .
.(2)A、B、C三种元素中第一电离能由小到大的顺序是N>O>C,电负性最大的是O(填元素符号):
(3)AC2-3的立体构型是平面三角形,其中A原子的轨道杂化类型为sp2;[D(AB)4]3-离子中配位数是4.
分析 前四周期原子序数依次增大的元素A、B、C、D中,A、B、C均处于第二周期且价电子层中未成对电子数分别为2、3、2,所以A、B、C的最外层电子数分别为4、5、6,则A为C,B为N,C为O,D为ds区元素且最外电子层上只排布了2个电子,D为第四周期元素,则D为Zn,据此答题;
解答 解:前四周期原子序数依次增大的元素A、B、C、D中,A、B、C均处于第二周期且价电子层中未成对电子数分别为2、3、2,所以A、B、C的最外层电子数分别为4、5、6,则A为C,B为N,C为O,D为ds区元素且最外电子层上只排布了2个电子,D为第四周期元素,则D为Zn,
(1)D为Zn,是30号元素,D2+的价层电子排布图为 ,
,
故答案为: ;
;
(2)根据元素周期律,同周期元素从左向右,电负性逐渐增大,第一电离也增大,但由于第ⅡA和ⅤA族元素的最外层电子数是一种稳定结构,所以它们的第一电离能都高于同周期相邻的元素,所经C、N、O三种元素中第一电离能由小到大的顺序是N>O>C,电负性最大的是O,
故答案为:N>O>C;O;
(3)CO2-3中碳原子的价层电子对数为$\frac{4+2}{2}$=3,碳原子没有孤电子对,所以CO2-3立体构型是平面三角形,其中碳原子的轨道杂化类型为sp2,Zn2+因为是3d全满,只能用外层杂化,Cu+可以形成配位数为2,也可以形成配位数为4的,在[Cu(CN)4]3-离子中.配位数是4,
故答案为:平面三角形;sp2;4.
点评 本题考查物质结构和性质,正确推断元素是解本题关键,难度中等,注意元素周期律的灵活运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法正确的是( )
| A. | 3.0g C2H6中含有共用电子对的数目为0.7×6.02×1023 | |
| B. | 25℃时pH=1的醋酸溶液中含有H+的数目为0.1×6.02×1023 | |
| C. | 已知2CO(g)+O2(g)?2CO2(g)△H=-a kg•mol-1,将2NA个CO与NA个O2混合,充分反应放出a kJ的热量 | |
| D. | 50mL 18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
13.已知0.01mol•L-1CH3COOH溶液和0.01mol•L-1CH3COONa溶液以等体积混合后溶液呈酸性,则该混合液中微粒浓度关系正确的( )
| A. | c(CH3COOH)>c(Na+) | B. | c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COOH)=c(CH3COO-)+c(H+) |
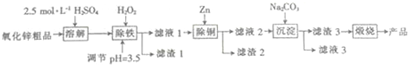
3.湿化学法(NPP一法)制备纳米级活性氧化锌,可以用氧化锌粗品(含有FeO、Fe2O3、CuO杂质)为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙烧获得活性氧化锌,其化学工艺流程如下:
已知溶液中Fe2+、Fe3+、Cu2+、Zn2+以氢氧化物的形式沉淀时的pH如表格:
(1)通过焰色反应可以检验产品中是否含有Na+,该实验的具体操作是将铂丝蘸盐酸在无色火焰上灼烧到无色,再蘸取少量产品在无色火焰上灼烧,观察火焰颜色,若呈黄色,则证明有Na+,反之,则证明没有Na+.
(2)上述流程图中用的Na2CO3溶液中阴离子的浓度由大到小的顺序为c(CO32-)>c(OH-)>c(HCO3-).
(3)滤渣1是Fe(OH)3(填化学式).加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(5)纳米活性氧化锌可用作氯乙烯聚合制取聚氯乙烯的催化剂,写出该反应的化学方程式:nCH2=CHCl$\stackrel{纳米活性氧化锌}{→}$ .
.

已知溶液中Fe2+、Fe3+、Cu2+、Zn2+以氢氧化物的形式沉淀时的pH如表格:
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.7 | 3.2 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9.0 |
(2)上述流程图中用的Na2CO3溶液中阴离子的浓度由大到小的顺序为c(CO32-)>c(OH-)>c(HCO3-).
(3)滤渣1是Fe(OH)3(填化学式).加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃-500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(5)纳米活性氧化锌可用作氯乙烯聚合制取聚氯乙烯的催化剂,写出该反应的化学方程式:nCH2=CHCl$\stackrel{纳米活性氧化锌}{→}$
 .
.
10.下列有关化学研究的正确说法是( )
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 只含一种元素的物质,一定不是化合物,但是可能是混合物 | |
| C. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| D. | 依据CO2、SO3、SiO2为酸性氧化物,可以得出结论:酸性氧化物均为非金属氧化物 |
7.下列与金属腐蚀有关的说法正确的是( )
| A. |  图中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 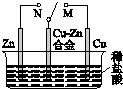 图中,开关由M改置于N时,Cu-Zn合金的腐蚀速率加快 | |
| C. | 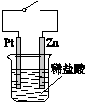 图中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 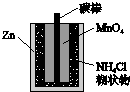 图中,Zn-MnO2干电池为一次性电池,将NH4Cl换成湿的KOH后电池性能更好 |

 (1)中和热测定实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒
(1)中和热测定实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒