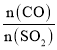题目内容
【题目】(1)往2L密闭容器中充入1molN2和3molH2,在一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气体中NH3的体积分数为25%,则:
①0~2min内,v(NH3)=_________。
②H2在平衡混合气中的体积分数=_________。
③平衡时容器的压强与起始时的压强之比为_________。
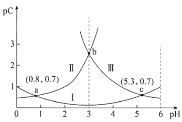
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

①该反应的化学方程式为_____________。
②2min反应达平衡容器内混合气体的平均相对分子质量比起始时____________(填“大”,“小”或“相等”下同),混合气体密度比起始时____________。
③上述反应在第2min时,X的转化率为_________
④将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
【答案】0.2mol·L-1·min-1 56.25% 4∶5 3X+Y![]() 2Z 大 相等 30% 5∶3
2Z 大 相等 30% 5∶3
【解析】
(1)运用三段式法,根据反应速率表达式及阿伏伽德罗定律分析解答;(2)根据图示反应过程中各组分的物质的量变化书写方程式,根据转化率表达式进行相关计算。
(1)发生3H2+N22NH3,设参加反应的氮气的物质的量为xmol,则
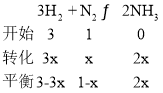
测得平衡混合气中NH3的体积分数为25%,则![]() ,解得x=0.4mol;
,解得x=0.4mol;
① 0~2min内,v(NH3)=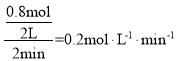 ,故答案为:0.2molL-1min-1;
,故答案为:0.2molL-1min-1;
② H2在平衡时的体积分数为![]() ,故答案为:56.25%;
,故答案为:56.25%;
③ 平衡时容器内的压强与起始时压强之比为![]() ,故答案为:4:5;
,故答案为:4:5;
(2)① 根据图示分析,X和Y是反应物,X、Y、Z的变化量之比是(1.0-0.7)mol:(1.0-0.9)mol:0.2mol=3:1:2,该反应的化学方程式为:3X+Y2Z,故答案为:3X+Y2Z;
② 混合气体的平均相摩尔质量![]() ,从开始到平衡气体的总质量不变,但n逐渐减小,所以2min反应达平衡容器内混合气体的平均相对分子质量比起始时大;混合气体密度
,从开始到平衡气体的总质量不变,但n逐渐减小,所以2min反应达平衡容器内混合气体的平均相对分子质量比起始时大;混合气体密度![]() ,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,故答案为:大;相等;③ 2min时X的转化率=
,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,故答案为:大;相等;③ 2min时X的转化率=![]() 故答案为:30%;
故答案为:30%;
④ 设反应到某时刻时,Y反应了xmol,则

则a-3x=b-x=2x,解得a=5x,b=3x,则a:b=5:3,故答案为:5∶3。

【题目】“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中错误的是( )
A | B | C | D |
|
|
|
|
用灼烧法可鉴别羊毫与尼龙毫的真伪 | 墨的主要成分是碳单质 | 纸的主要成分属于合成材料 | 用石材制作砚台的过程是物理变化 |
A.AB.BC.CD.D