题目内容
【题目】以下微粒含配位键的是( )
①N2H![]() ②CH4 ③OH- ④NH
②CH4 ③OH- ④NH![]() ⑤Fe(CO)3
⑤Fe(CO)3
⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧ D. 全部
【答案】C
【解析】①氢离子提供空轨道,N2H4氮原子提供孤电子对,所以能形成配位键,N2H5+含有配位键;②甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键;③OH-电子式为![]() ,无空轨道,OH-不含有配位键;④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键;⑤Fe3+有空轨道,CO中的氧原子上的孤电子对,可以形成配位键,Fe(CO)3含有配位键;⑥SCN-的电子式
,无空轨道,OH-不含有配位键;④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键;⑤Fe3+有空轨道,CO中的氧原子上的孤电子对,可以形成配位键,Fe(CO)3含有配位键;⑥SCN-的电子式![]() ,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键;⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,Ag(NH3)2OH含有配位键;故选C。
,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键;⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,Ag(NH3)2OH含有配位键;故选C。

【题目】由下列实验及现象能推出相应结论的是( )
实验 | 实验现象 | 实验结论 | |
A | 用洁净的铂丝蘸取少量溶液在酒精灯外焰上灼烧 | 火焰呈黄色 | 该溶液中一定含有Na+,无K+ |
B | 向某溶液中加入BaCl2溶液 | 有白色沉淀 | 该溶液中一定有SO |
C | 将某气体通入品红溶液 | 红色褪去 | 该气体一定是SO2 |
D | 将一小块用砂纸打磨过的铝箔在酒精灯上加热 | 熔化的液态铝不会滴落 | 表面生成的Al2O3薄膜熔点较高 |
A.AB.BC.CD.D
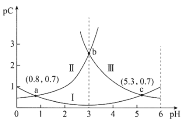
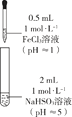
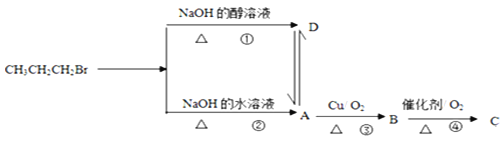
【题目】某同学欲探究FeCl3溶液与NaHSO3溶液的反应,设计、完成实验并记录如下:
装置 | 反应时间 | 实验现象 |
| 0~1 min | 产生红褐色沉淀Fe(OH)3,有刺激性气味气体SO2逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | |
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
已知: Fe(OH)3+SO32-![]()
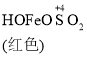
![]()
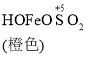
![]() Fe2++SO42-
Fe2++SO42-
下列有关反应速率和化学平衡说法不正确的是
A. 生成红色配合物的反应速率较快,红色配合物生成橙色配合物的速率较慢
B. 增大溶液中SO32-浓度可以加速红褐色沉淀Fe(OH)3迅速溶解
C. O2的作用下,橙色HOFeOSO2浓度下降,平衡![]() 不断正向移动
不断正向移动
D. 30min时,若向该无色溶液中滴加少量FeCl3溶液,无明显现象