题目内容
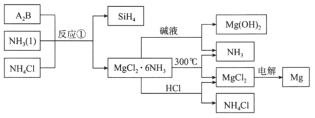
【题目】图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。下列说法错误的是
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2·6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
【答案】C
【解析】
由反应①可知A2B应为Mg2Si,与氨气、氯化铵反应生成SiH4和MgCl26NH3,MgCl26NH3加入碱液,可生成Mg(OH)2,MgCl26NH3加热时不稳定,可分解生成氨气,同时生成氯化镁,电解熔融的氯化镁,可生成镁,用于工业冶炼,而MgCl26NH3与盐酸反应,可生成氯化镁、氯化铵,其中氨气、氯化铵可用于反应①而循环使用,以此解答该题。
A.由分析知A2B的化学式为Mg2Si,故A正确;
B.反应①需要氨气和NH4Cl,而由流程可知MgCl26NH3加热或与盐酸反应,生成的氨气、氯化铵,参与反应①而循环使用,故B正确;
C.由流程可知MgCl2·6NH3高温分解生成MgCl2,再电解MgCl2制取镁均发生分解反应,故C错误;
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热,灼烧,都是氧化镁,最终得到的固体相同,故D正确;
故答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】由下列实验及现象能推出相应结论的是( )
实验 | 实验现象 | 实验结论 | |
A | 用洁净的铂丝蘸取少量溶液在酒精灯外焰上灼烧 | 火焰呈黄色 | 该溶液中一定含有Na+,无K+ |
B | 向某溶液中加入BaCl2溶液 | 有白色沉淀 | 该溶液中一定有SO |
C | 将某气体通入品红溶液 | 红色褪去 | 该气体一定是SO2 |
D | 将一小块用砂纸打磨过的铝箔在酒精灯上加热 | 熔化的液态铝不会滴落 | 表面生成的Al2O3薄膜熔点较高 |
A.AB.BC.CD.D
【题目】某同学欲探究FeCl3溶液与NaHSO3溶液的反应,设计、完成实验并记录如下:
装置 | 反应时间 | 实验现象 |
| 0~1 min | 产生红褐色沉淀Fe(OH)3,有刺激性气味气体SO2逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | |
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
已知: Fe(OH)3+SO32-![]()
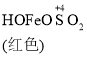
![]()
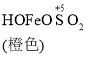
![]() Fe2++SO42-
Fe2++SO42-
下列有关反应速率和化学平衡说法不正确的是
A. 生成红色配合物的反应速率较快,红色配合物生成橙色配合物的速率较慢
B. 增大溶液中SO32-浓度可以加速红褐色沉淀Fe(OH)3迅速溶解
C. O2的作用下,橙色HOFeOSO2浓度下降,平衡![]() 不断正向移动
不断正向移动
D. 30min时,若向该无色溶液中滴加少量FeCl3溶液,无明显现象