题目内容
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为____________,若将负极材料改为CH4,写出其负极反应方程式___________。
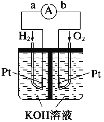
(2)NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2 mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为__________;每消耗3.4g NH3转移的电子数目为_________。
【答案】O2 + 2H2O + 4e- = 4OH- CH4 + 10OH- - 8e- =![]() + 7H2O 2NH3 + 6OH- -6e- =N2 + 6H2O 0.6NA
+ 7H2O 2NH3 + 6OH- -6e- =N2 + 6H2O 0.6NA
【解析】
在原电池中,负极上失电子,燃料发生氧化反应,正极上得电子,氧气发生还原反应。
(1)氢氧燃料电池正极上氧气得电子,发生还原反应,电解质是碱,则生成OH-,反应式为:O2 + 2H2O + 4e- = 4OH-,若将负极材料改为CH4,在碱性条件下应该生成![]() ,总反应式为:CH4 +2O2+2OH- =
,总反应式为:CH4 +2O2+2OH- =![]() +3H2O,正极反应为:2O2 + 4H2O + 8e- = 8OH-,两式相减得负极反应方程式为:CH4 + 10OH- - 8e- =
+3H2O,正极反应为:2O2 + 4H2O + 8e- = 8OH-,两式相减得负极反应方程式为:CH4 + 10OH- - 8e- =![]() + 7H2O;
+ 7H2O;
(2) NH3代替氢气,电解质溶液是KOH溶液没有变,则正极反应式也没有变化,电池总反应为:4NH3+3O2=2N2+6H2O,正极反应为:3O2 + 6H2O + 12e- = 12OH-,两式相减得负极反应方程式为:4NH3 + 12OH- -12e- =2N2 + 12H2O,即为2NH3 + 6OH- -6e- =N2 + 6H2O;3.4g NH3物质的量为:![]() ,根据负极反应可知,2mol NH3转移6mol电子,则3.4g NH3转移的电子数目为0.6 mol,即0.6NA。
,根据负极反应可知,2mol NH3转移6mol电子,则3.4g NH3转移的电子数目为0.6 mol,即0.6NA。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
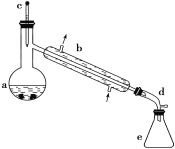
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__________。
(2)本实验中最容易产生的副产物的结构简式为_______。
(3)在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是______。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有____(填正确答案标号)。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(6)以下区分环己烯精品和粗品的方法,合理的是______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%