题目内容
20.部分弱电解质的电离平衡常数如下表,以下选项错误的是( )| 化学式 | NH3•H2O | CH3COOH | HCN | H2CO3 |
| Ki(25℃) | 1.8×l0-5 | 1.8×l0-5 | 4.9×l0-10 | Ki1=4.3×l0-7 Ki2=5.6×l0-11 |
| A. | 等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大 | |
| B. | 0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4 溶液显中性 | |
| C. | CN-+H2O+CO2→HCN+HCO3- | |
| D. | 中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者 |
分析 电离常数越大酸性越强,所以酸性:CH3COOH>H2CO3>HCN>HCO3-,
A、酸性越弱水解程度越大,水的电离程度越大;
B、NH3•H2O和醋酸的电离程度相同,其离子的水解程度相同;
C、酸性强的酸能制备酸性弱的酸;
D、pH相同时,酸性越弱,酸的浓度越大.
解答 解:电离常数越大酸性越强,所以酸性:CH3COOH>H2CO3>HCN>HCO3-,
A、酸性越弱水解程度越大,水的电离程度越大,已知酸性:H2CO3>HCN,所以水的电离程度:NaCN>NaHCO3,故A错误;
B、0.1 mol/L CH3COONa溶液中醋酸根离子水解显碱性,0.1 mol/L CH3COONH4中铵根离子和醋酸根离子的水解程度相同,则溶液显中性,故B正确;
C、酸性强的酸能制备酸性弱的酸,已知酸性:H2CO3>HCN>HCO3-,所以CN-+H2O+CO2→HCN+HCO3-,故C正确;
D、pH相同时,酸性越弱,酸的浓度越大,所以等pH的CH3COOH和HCN,CH3COOH的浓度小,则CH3COOH消耗的NaOH少,故D正确;
故选A.
点评 本题考查了弱酸的电离平衡及影响因素,盐的水解原理的应用等,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
10.利用下列实验装置能 完成相应实验的是( )
| A. |  装置测定化学反应速率 | B. | 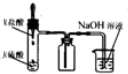 装置制取并吸收HCl | ||
| C. |  装置制备纯净NH3 | D. |  装置比较MnO2、Cl2、S |
11.铜与浓硫酸反应结束后,烧瓶中铜片未完全溶解.若向反应后的溶液中加入下列物质,相关推断错误的是( )
| A. | 加入铁粉,铁粉不溶解 | B. | 滴入NaNO3溶液,铜片不溶解 | ||
| C. | 加入银粉,银粉不溶解 | D. | 滴入NaHCO3溶液,有气体产生 |
15.单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高.下列溶液中沸点最高的是( )
| A. | 0.01 mol/L的蔗糖溶液 | B. | 0.02 mol/L的CH3COOH溶液 | ||
| C. | 0.02 mol/L的NaCl溶液 | D. | 0.01 mol/L的K2SO4溶液 |
5.2014年全国多个城市出现了严重的雾霾天气,十面“霾”伏,自强不“吸”等网络语流行,( )
| A. | 目前加碘食盐中主要添加的是KI | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 淀粉、纤维素和聚乙烯都属于天然高分子化合物 | |
| D. | 光纤通信使用的光缆的主要成分和太阳能电池使用的材料都是SiO2 |
12.下列关于化学与生产、生活的认识正确的是( )
| A. | 用米汤检验含碘盐中的碘酸钾 | |
| B. | 纤维素、蛋白质、塑料、天然橡胶都是高分子化合物 | |
| C. | 日常生活中常用无水乙醇进行杀菌消毒 | |
| D. | 光化学烟雾、臭氧层空洞、温室效应、硝酸型酸雨的形成都与氮氧化合物有关 |
9.高铁电池是一种新型可充电电池,电解液为KOH溶液,放电时的总反应式为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH下列叙述正确的是( )
| A. | 放电时,正极区溶液的pH减小 | |
| B. | 该电用电可用稀H2SO4代替KOH溶液 | |
| C. | 充电时,电解质溶液中的K+等阳离子向Zn电极移动 | |
| D. | 充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 |
14.短周期元素X、Y、Z、W、Q原子序数逐渐增大,X的氢化物极易溶于Y的氢化物,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.由此得出的正确结论是( )
| A. | 元素Y的最高正价是+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 元素X的最高价氧化物对应水化物的酸性比Q的强 | |
| D. | 氢化物的沸点Y>W |

 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.
;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.