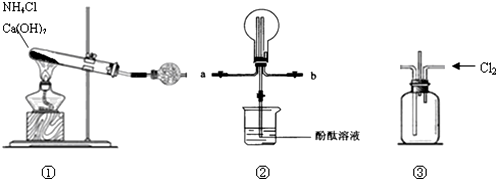
题目内容
11.第四周期过渡元素常与H2O、NH3等形成配合物.(1)写出Cu元素基态原子的核外电子排布1s22s22p63s23p63d104s1;
(2)已知铜离子可形成配位数为4的配合物,向盛有硫酸铜水溶液的试管里加入过量氨水,得到深蓝色溶液,写出该反应的离子方程式Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O或Cu2++4NH3=[Cu(NH3)4]2+;向溶液中加入乙醇后产生的现象是析出蓝色晶体,原因为硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度
(3)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子.甲和乙的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272.26 | 425.25 | 以任意比互溶 |
②丙分子的中心原子采取sp3杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子间存在氢键,因此熔沸点更高;H2O2与水分子可形成氢键,可以与水任意比互溶(结合具体物质解释).
分析 (1)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(2)硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物,根据反应写出离子反应方程式;硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度向溶液中加入乙醇后析出蓝色晶体硫酸四氨合铜;
(3)根据题目信息可知甲为H2S,乙为H2O2,丙为C2H6,
①1个H2O2中含有3个共价单键,即3个个σ键;
②对于有机物利用杂化轨道数=孤对电子对数+σ键数进行判断;
③H2O2分子间存在氢键以及H2O2分子与水分子可形成氢键来解答.
解答 解:(1)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,总反应为:Cu2++4NH3•H2O═[Cu(NH3)4]2++4H2O、或Cu2++4NH3=[Cu(NH3)4]2+;硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度向溶液中加入乙醇后析出蓝色晶体硫酸四氨合铜,
故答案为:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O或Cu2++4NH3=[Cu(NH3)4]2+;析出蓝色晶体;硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度;
(3)①1个H2O2中含有3个共价单键,即3个个σ键,所以1molH2O2分子含有3NA个σ键,故答案为:3NA;
②C2H6分子中碳原子形成3个C-H,1个C-C双键,C原子杂化轨道数为(3+1)=4,C原子采取sp3杂化方式,故答案为:sp3;
③H2O2分子间存在氢键,所以熔沸点比H2S高;H2O2分子与水分子可形成氢键,所以与任意比互溶,故答案为:H2O2分子间存在氢键,因此熔沸点更高;H2O2与水分子可形成氢键,可以与水任意比互溶.
点评 本题考查物质结构与性质,明确原子序数、电子排布、配合物的性质、杂化理论等知识是解答关键,题目难度中等.

| A. | 1-甲基戊烷 | B. | 2-乙基-1-丙烯 | ||
| C. | 3,3-二甲基-1-丁醇 | D. | 1,3,5-三硝基甲苯 |
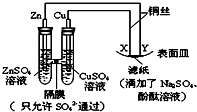
| A. | Y为阴极,发生还原反应 | B. | X为正极,发生氧化反应 | ||
| C. | 锌电极表面有红色的铜析出 | D. | X与滤纸接触处变红 |
| A. | 常温常压下,1mol固体氢氧化钠的体积比1mol氢气的体积小 | |
| B. | NA个氧气分子和NA个氢气分子的质量比为16:l | |
| C. | 28g氮气所含的原子数目为NA | |
| D. | NA个H2SO4分子中所含氧原子个数与4NA个H2O分子中所含氧原子个数相等 |
| A. | 稀H2SO4 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Fe2(SO4)3溶液 |
| A. | 常温常压下,16g O2和32g O3的混合物中,含有O原子数目为3NA | |
| B. | 标准状态下,1mol Na2O和1mol Na2O2的混合物中,含有离子总数为7NA | |
| C. | 1mol NaHSO4溶于水或受热熔化,电离出来的离子数目均为2NA | |
| D. | 在K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O中,若生成71g Cl2,转移的电子数目为$\frac{5}{3}$NA |
| 品名 | 苏打饼干 |
| 配料 | 面料、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、苏打 |
| 保质期 | 12个月 |
| 生产日期 | 2015年5月15日 |
| A. | 精炼食用植物油能使溴水和酸性KMnO4溶液褪色 | |
| B. | 白砂糖属于二糖,在人体内水解而转化为单糖 | |
| C. | 鲜鸡蛋清遇浓硝酸变为黄色 | |
| D. | 奶油与白砂糖都是高分子化合物 |