题目内容
6.设NA表示阿伏加德罗常数,下列说法不正确的是( )| A. | 常温常压下,1mol固体氢氧化钠的体积比1mol氢气的体积小 | |
| B. | NA个氧气分子和NA个氢气分子的质量比为16:l | |
| C. | 28g氮气所含的原子数目为NA | |
| D. | NA个H2SO4分子中所含氧原子个数与4NA个H2O分子中所含氧原子个数相等 |
分析 A.固体氢氧化钠密度常温下为2.13克/立方厘米,1mol是40g,远远小于1L,而1mol氢气的体积小常温常压下,体积大于22.4L;
B.氧气和氢气的个数相同,物质的量相等,质量比就等于摩尔质量之比;
C.根据n=$\frac{m}{M}$计算28g氮气的物质的量,每个氮气分子含有2个氮原子,根据N=nNA计算氮原子的数目;
D.1个硫酸分子含有4个氧原子,1个水分子含有1个氧原子.
解答 解:A.固体氢氧化钠密度常温下为2.13克/立方厘米,1mol是40g,远远小于1L,而1mol氢气的体积小常温常压下,体积大于22.4L,故A正确;
B.NA个氧气分子和NA个氢气分子的物质的量相等,质量比就等于摩尔质量之比,故B正确;
C.28g氮气的物质的量为$\frac{28g}{28g/mol}$=1mol,每个氮气分子含有2个氮原子,含有氮原子数目为为1mol×2×NAmol-1=2NA,故C错误;
D.NA个H2SO4分子中所含氧原子个数为4NA,4NA个H2O分子中所含氧原子个数为4NA,二者相等,故D正确;
故选:C.
点评 本题考查阿伏伽德罗常数的有关计算,灵活运用基本公式是解本题关键,注意气体摩尔体积的适用范围和条件.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
16.下列物质的分类组合正确的是( )
| A | B | C | D | |
| 化合物 | HCl | NaOH | Cu2(OH)2SO4 | FeSO4•7H2O |
| 氧化物 | H2O | Na2O | CO | Fe3O4 |
| 电解质 | 浓盐酸 | 纯碱 | 胆矾溶液 | 铁 |
| A. | A | B. | B | C. | C | D. | D |
17.在一定温度下,在恒容的密闭容器中进行的可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | C生成的速率和C分解的速率相等 | |
| B. | 单位时间内生成n mol A,同时生成3n mol B | |
| C. | B的消耗速率与C的消耗速率之比为1:1 | |
| D. | 混合气体密度保持不变 |
14.下列化学用语使用正确的是( )
| A. | NH4Cl的电子式: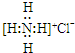 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氟化钠的电子式: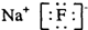 | |
| D. | 氯原子的结构示意图: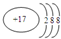 |
1.将反应Mn2++Bi3-+H+→MnO4-+Bi3++H2O配平后,H+的化学计量数为( )
| A. | 8 | B. | 10 | C. | 14 | D. | 30 |
11.第四周期过渡元素常与H2O、NH3等形成配合物.
(1)写出Cu元素基态原子的核外电子排布1s22s22p63s23p63d104s1;
(2)已知铜离子可形成配位数为4的配合物,向盛有硫酸铜水溶液的试管里加入过量氨水,得到深蓝色溶液,写出该反应的离子方程式Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O或Cu2++4NH3=[Cu(NH3)4]2+;向溶液中加入乙醇后产生的现象是析出蓝色晶体,原因为硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度
(3)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子.甲和乙的主要物理性质比较如下:
①1mol乙分子含有3NA个σ键;
②丙分子的中心原子采取sp3杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子间存在氢键,因此熔沸点更高;H2O2与水分子可形成氢键,可以与水任意比互溶(结合具体物质解释).
(1)写出Cu元素基态原子的核外电子排布1s22s22p63s23p63d104s1;
(2)已知铜离子可形成配位数为4的配合物,向盛有硫酸铜水溶液的试管里加入过量氨水,得到深蓝色溶液,写出该反应的离子方程式Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O或Cu2++4NH3=[Cu(NH3)4]2+;向溶液中加入乙醇后产生的现象是析出蓝色晶体,原因为硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度
(3)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子.甲和乙的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272.26 | 425.25 | 以任意比互溶 |
②丙分子的中心原子采取sp3杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子间存在氢键,因此熔沸点更高;H2O2与水分子可形成氢键,可以与水任意比互溶(结合具体物质解释).
18.下列各组离子在饱和氯水中能大量共存的是( )
| A. | Fe2+、Na+、Cl-、NO3- | B. | Na+、Al3+、SO42-、Cl- | ||
| C. | NH4+、K+、NO3-、Br- | D. | Na+、K+、HCO3-、SiO32- |
15.下列制备实验不可能成功的是( )
| A. | 将冰醋酸、乙醇和浓硫酸混合共热制取乙酸乙酯 | |
| B. | 将乙醇和3mol/L的硫酸按体积比1:3混合共热至170℃制乙烯 | |
| C. | 蔗糖在酸性条件下水解后与新制的氢氧化铜共热能看到红色沉淀 | |
| D. | 用苯、液溴和还原铁粉制溴苯 |
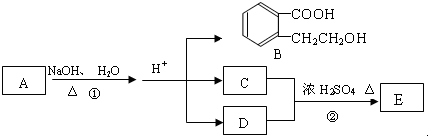
 .(不用写条件)
.(不用写条件)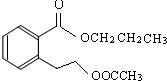 .
.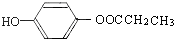 .
.