题目内容
19.如图所示,下列叙述正确的是( )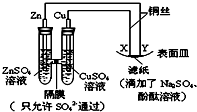
| A. | Y为阴极,发生还原反应 | B. | X为正极,发生氧化反应 | ||
| C. | 锌电极表面有红色的铜析出 | D. | X与滤纸接触处变红 |
分析 左边装置是原电池,较活泼的金属锌作负极,铜作正极,右边装置相当于电解池,与原电池负极相连的是阴极,与原电池正极相连的是阳极,阴极上得电子发生还原反应,阳极上失电子发生氧化反应.
解答 解:A.在Zn、Cu、CuSO4构成的原电池中,锌做负极,铜做正极,和原电池的正极相连的是电解池的阳极,和原电池的负极相连的是电解池的阴极,所以Y为阴极,发生还原反应,故A正确;
B.X连接原电池正极,为电解池阳极,故B错误;
C.锌为原电池负极,被氧化生成锌离子,故C错误;
D.X为正极,发生氧化反应生成氧气和氢离子,滴加酚酞不变色,故D错误.
故选A.
点评 本题考查了原电池和电解池原理,根据原电池和电解池的判断方法、电解池中阴阳极的判断方法及反应类型来解答,难度不大.

练习册系列答案
相关题目
7.下列反应中是吸热反应的是( )
| A. | 氧化钙溶于水 | B. | 乙醇燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 碳酸钙受热分解 |
14.下列化学用语使用正确的是( )
| A. | NH4Cl的电子式: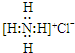 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氟化钠的电子式: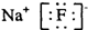 | |
| D. | 氯原子的结构示意图: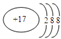 |
4.用蒸馏水润湿pH试纸(每一次使用时润湿程度相同)测定溶液的pH,下列说法正确的是( )
| A. | 测定值一定有误差 | |
| B. | 测定值一定没有误差 | |
| C. | 测出的Na2CO3溶液的pH偏小 | |
| D. | 用此方法测H+浓度相同的盐酸和醋酸时,盐酸的pH比醋酸小 |
11.第四周期过渡元素常与H2O、NH3等形成配合物.
(1)写出Cu元素基态原子的核外电子排布1s22s22p63s23p63d104s1;
(2)已知铜离子可形成配位数为4的配合物,向盛有硫酸铜水溶液的试管里加入过量氨水,得到深蓝色溶液,写出该反应的离子方程式Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O或Cu2++4NH3=[Cu(NH3)4]2+;向溶液中加入乙醇后产生的现象是析出蓝色晶体,原因为硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度
(3)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子.甲和乙的主要物理性质比较如下:
①1mol乙分子含有3NA个σ键;
②丙分子的中心原子采取sp3杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子间存在氢键,因此熔沸点更高;H2O2与水分子可形成氢键,可以与水任意比互溶(结合具体物质解释).
(1)写出Cu元素基态原子的核外电子排布1s22s22p63s23p63d104s1;
(2)已知铜离子可形成配位数为4的配合物,向盛有硫酸铜水溶液的试管里加入过量氨水,得到深蓝色溶液,写出该反应的离子方程式Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O或Cu2++4NH3=[Cu(NH3)4]2+;向溶液中加入乙醇后产生的现象是析出蓝色晶体,原因为硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度
(3)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子.甲和乙的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272.26 | 425.25 | 以任意比互溶 |
②丙分子的中心原子采取sp3杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子间存在氢键,因此熔沸点更高;H2O2与水分子可形成氢键,可以与水任意比互溶(结合具体物质解释).
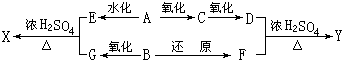
8. 铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
 铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )
铅蓄电池是常用的汽车电池.其结构如图所示.铅蓄电池以铅板为负极,表面蒙有大量二氧化铅的铅板作正极,以适当浓度的H2SO4作电解质溶液.已知PbSO4不溶于水也不溶于H2SO4.此电池放电的原理与普通原电池相同,充电时则相当于电解池.下列关于铅蓄电池的说法中正确的是( )| A. | 放电时,负极质量减小,正极质量增大 | |
| B. | 放电时,当电路中通过2mol e-时,消耗2mol H2SO4 | |
| C. | 放电时,溶液中SO${\;}_{4}^{2-}$向正极区移动 | |
| D. | 放电时,整个电解质溶液的pH逐渐变大 |
14.已知:H2O(g)=H2O(l)△H=Q1 kJ/mol
C2H5OH(g)═C2H5OH(l)△H=Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3kJ/mol
若使46克酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
C2H5OH(g)═C2H5OH(l)△H=Q2 kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3kJ/mol
若使46克酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | ( Q1+Q2+Q3 ) kJ | B. | 0.5( Q1+Q2+Q3 ) kJ | ||
| C. | ( 0.5Q1-1.5Q2+0.5Q3 ) kJ | D. | ( 3Q1-Q2+Q3 ) kJ |
 HCOOC2H5+H2O.
HCOOC2H5+H2O.