题目内容
2.下列有机物的命名正确的是( )| A. | 1-甲基戊烷 | B. | 2-乙基-1-丙烯 | ||
| C. | 3,3-二甲基-1-丁醇 | D. | 1,3,5-三硝基甲苯 |
分析 A、烷烃命名中出现1-甲基,说明选取的不是最长碳链;
B、丙烯中出现2-乙基,说明选取不是最长碳链;
C、醇类命名选取距离羟基最近的一端命名为1号碳;
D、甲基与硝基不能同时连在苯环的1个碳上.
解答 解:A、1-甲基戊烷,主链选取错误,正确命名为:己烷,故A错误;
B、2-乙基-1-丙烯,主链选取错误,正确命名为2-甲基-1-丁烯,故B错误;
C、3,3-二甲基-1-丁醇,符合醇类命名原则,故C正确;
D、1,3,5-三硝基甲苯,编号时甲基所在的碳原子应该为1号,所以在1号C含有5个共价键,故D错误;故选C.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
12.100mL 0.3mol•L-1的Na2SO4溶液和50ml 0.2mol•L-1的Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )[提示:稀溶液混合后,其体积可以相加].
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.5 mol•L-1 |
13.在Fe(NO3)2溶液中存在下列平衡:Fe2++2H2O?2Fe(OH)2+2H+,又已知Fe2+的颜色为浅绿色.现向该溶液中加入稀盐酸,则溶液的颜色为( )
| A. | 无变化 | B. | 变为无色 | C. | 变为深绿色 | D. | 变为棕黄色 |
17.在一定温度下,在恒容的密闭容器中进行的可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | C生成的速率和C分解的速率相等 | |
| B. | 单位时间内生成n mol A,同时生成3n mol B | |
| C. | B的消耗速率与C的消耗速率之比为1:1 | |
| D. | 混合气体密度保持不变 |
7.下列反应中是吸热反应的是( )
| A. | 氧化钙溶于水 | B. | 乙醇燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 碳酸钙受热分解 |
14.下列化学用语使用正确的是( )
| A. | NH4Cl的电子式: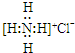 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氟化钠的电子式: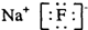 | |
| D. | 氯原子的结构示意图: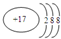 |
11.第四周期过渡元素常与H2O、NH3等形成配合物.
(1)写出Cu元素基态原子的核外电子排布1s22s22p63s23p63d104s1;
(2)已知铜离子可形成配位数为4的配合物,向盛有硫酸铜水溶液的试管里加入过量氨水,得到深蓝色溶液,写出该反应的离子方程式Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O或Cu2++4NH3=[Cu(NH3)4]2+;向溶液中加入乙醇后产生的现象是析出蓝色晶体,原因为硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度
(3)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子.甲和乙的主要物理性质比较如下:
①1mol乙分子含有3NA个σ键;
②丙分子的中心原子采取sp3杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子间存在氢键,因此熔沸点更高;H2O2与水分子可形成氢键,可以与水任意比互溶(结合具体物质解释).
(1)写出Cu元素基态原子的核外电子排布1s22s22p63s23p63d104s1;
(2)已知铜离子可形成配位数为4的配合物,向盛有硫酸铜水溶液的试管里加入过量氨水,得到深蓝色溶液,写出该反应的离子方程式Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O或Cu2++4NH3=[Cu(NH3)4]2+;向溶液中加入乙醇后产生的现象是析出蓝色晶体,原因为硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度
(3)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子.甲和乙的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272.26 | 425.25 | 以任意比互溶 |
②丙分子的中心原子采取sp3杂化轨道;
③甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是H2O2分子间存在氢键,因此熔沸点更高;H2O2与水分子可形成氢键,可以与水任意比互溶(结合具体物质解释).
12.下列化合物中,熔沸点最高的是( )
| A. | NaCl | B. | MgCl2 | C. | NaBr | D. | NaI |
 HCOOC2H5+H2O.
HCOOC2H5+H2O.