题目内容
11.下列有关(NH4)2SO3溶液的叙述正确的是( )| A. | 该溶液中,Na+、Fe3+、NO3-、Cl-可能大量共存 | |
| B. | 和溴水反应的离子方程式:Br2+SO32-+H2O=2H++2Br-+SO42- | |
| C. | 和Ba(OH)2溶液加热反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 1L0.1mol•L-1该溶液和足量的硝酸充分反应,生成2.24L(标准状况)SO2气体 |
分析 A.(NH4)2SO3溶液中存在亚硫酸根离子,铁离子能够氧化亚硫酸根离子;
B.溴单质能够将亚硫酸根离子氧化硫酸根离子;
C.漏掉了生成亚硫酸钡的反应;
D.二者反应生成硫酸铵,不会生成二氧化硫气体.
解答 解:(NH4)2SO3在溶液中电离出铵根离子和亚硫酸根离子,
A.Fe3+具有氧化性,能够氧化亚硫酸根离子,在溶液中不能大量共存,故A错误;
B.亚硫酸铵和溴水反应生成硫酸铵和溴化氢,反应的离子方程式为:Br2+SO32-+H2O=2H++2Br-+SO42-,故B正确;
C.(NH4)2SO3和Ba(OH)2溶液加热反应生成氨气、亚硫酸钡和水,正确的离子方程式为:Ba2++SO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaSO3↓,故C错误;
D.稀硝酸具有强氧化性,将亚硫酸根离子氧化成硫酸根离子,不会生成二氧化硫气体,故D错误;
故选B.
点评 本题考查了离子共存的判断、离子方程式和化学方程式书写,题目难度中等,注意掌握离子反应发生条件、离子方程式和化学方程式的书写原则,明确离子共存的判断方法,D为易错点,注意反应生成硫酸铵,不会生成二氧化硫.

练习册系列答案
相关题目
1.构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序.若以E表示某能级的能量,下列能量大小顺序中正确的是( )
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
19.W、X、Y、Z均是短周期元素,W元素原子的最外层电子数与次外层电子数之差的绝对值等于其电子层数,X元素的原子比W元素的原子多2个电子;Y+和Z-离子具有与氖原子相同的电子层结构.下列说法错误的是( )
| A. | 上述元素中,Y的原子半径最大 | |
| B. | 上述元素中,W的气态氢化物最稳定 | |
| C. | 元素W和X可形成含有极性键的极性分子WX3 | |
| D. | 工业上可用电解熔融的Y、Z的化合物的方法冶炼Y、Z的单质 |
6.25℃时,将Na2O2逐渐加入1L含有HCl、AlCl3、MgCl2的混合溶液中,产生沉淀和气体的量与加入Na2O2的量的关系如图所示(假设整个过程中溶液条件变化忽略不计).下列说法错误的是( )
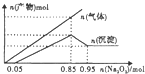

| A. | 混合溶液中m(Al3+)为5.4g | B. | 混合溶液中c(Mg2+)为0.5mol/L | ||
| C. | 混合溶液的pH=2 | D. | 混合溶液中c(Cl-)为1.7mol/L |
16.下列化学用语表达正确的有( )
①羟基的电子式: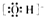
②次氯酸分子的结构式:H-O-Cl
③乙烯的最简式(实验式):CH2=CH2
④含有10个中子的氧原子:188O
⑤铝离子的结构示意图: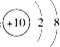
⑥二氧化碳分子的比例模型
①羟基的电子式:
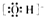
②次氯酸分子的结构式:H-O-Cl
③乙烯的最简式(实验式):CH2=CH2
④含有10个中子的氧原子:188O
⑤铝离子的结构示意图:
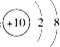
⑥二氧化碳分子的比例模型

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
3.下列说法正确的是( )
| A. | 正丁烷和异丁烷互为同分异构体 | |
| B. | 乙醇和乙酸都能与氢氧化钠溶液反应 | |
| C. | 淀粉和蛋白质的水解产物都是氨基酸 | |
| D. | 葡萄糖和蔗糖都能发生水解反应 |
20.短周期元素W、X、Y和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
1.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | CH4和Cl2混合于试管中光照,颜色逐渐褪去 | 二者发生了化合反应 |
| B | 微热滴有2滴酚酞的饱和NaHCO3溶液,溶液颜色加深 | NaHCO3受热分解生成了Na2CO3 |
| C | 向淀粉溶液中加入20%的硫酸,加热几分钟,冷却后再加入银氨溶液,水浴,没有银镜生成 | 淀粉没发生水解 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸,观察到试管口有红棕色气体产生 | 酸性环境下,NO3-被Fe2+还原为NO,NO遇氧气生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
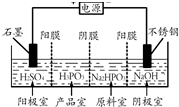 亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.
亚磷酸(H3PO3)可用作检测汞、金、银、铅、碘酸等的分析试剂.