题目内容
9.氢能是重要的新能源,储氢作为氢能利用的关键技术,是当前关注的热点之一.(1)氢气作为能源最大的优点是燃烧产物是水,无污染.请你再列举一条氢气作为能源的优点:原料来源广、热值高等.
(2)LiAlH4是一种重要的储氢载体,能与水反应得到LiAlO2和氢气,该反应消耗1molLiAlH4时转移的电子数目为4NA或2.408×1024.
(3)氮化锂(Li3N)是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为Li3N+2H2$\frac{\underline{\;\;△\;\;}}{\;}$LiNH2+2LiH,氧化产物为LiNH2(填化学式).在270℃时,该反应可逆向发生放出H2,因而氨化锂可作为储氢材料,储存氢气最多可达Li3N质量的11.4%(精确到0.1)
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$ (g)+3H2(g)△H
(g)+3H2(g)△H在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol•L-1,平衡时苯的浓度为b mol•L-1,该反应的平衡常数K=$\frac{27{b}^{4}}{a-b}$mol3•L-3.
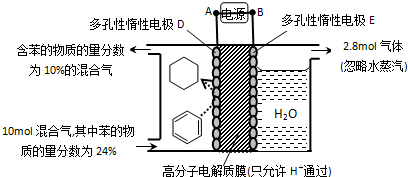
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).
①导线中电子移动方向为A→D(用A、D表示)
②生成目标产物的电极反应式为C6H6+6H++6e-=C6H12.
③该储氢装置的电流效率η=64.3%.(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%,计算结果保留小数点后1位)
分析 (1)氢气来源于水,氢气燃烧放出大量的热;
(2)LiAlH4与水反应得到LiAlO2和氢气,只有H元素的化合价变化,反应消耗1molLiAlH4时,4molH失去电子;
(3)Li2N+2H2$\frac{\underline{\;\;△\;\;}}{\;}$LiNH2+2LiH中,氢气化合价由0变成+1价,由0降低为-1价;结合反应可知Li3N~2H2,以此计算,
(4)化学平衡常数K=$\frac{c({C}_{6}{H}_{6}){c}^{3}({H}_{2})}{c({C}_{6}H12)}$;
(5)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是分解、B是正极,电子从负极流向阴极;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
③阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η.
解答 解:(1)氢气来源于水,氢气燃烧放出大量的热,则氢气作为能源的优点为原料来源广、热值高等,故答案为:原料来源广、热值高等;
(2)LiAlH4与水反应得到LiAlO2和氢气,只有H元素的化合价变化,反应消耗1molLiAlH4时,4molH失去电子,则转移电子为4NA或2.408×1024个,
故答案为:4NA或2.408×1024;
(3)反应Li3N+2H2$\frac{\underline{\;\;△\;\;}}{\;}$LiNH2+2LiH中,锂元素、N元素化合价不变,氢元素化合价由0变成+1价的LiNH2,化合价升高被氧化,所以氧化产物为LiNH2;
该反应中,Li3N~2H2,所以储存氢气最多可达Li3N质量的:$\frac{4}{35}$×100%≈11.4%,
故答案为:LiNH2;11.4;
(4)环己烷的起始浓度为amol•L-1,平衡时苯的浓度为bmol•L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,则平衡常数K=$\frac{c({C}_{6}{H}_{6}){c}^{3}({H}_{2})}{c({C}_{6}H12)}$mol3•L-3=$\frac{b×(3b)^{3}}{(a-b)}$=$\frac{27{b}^{4}}{a-b}$mol3•L-3,
故答案为:$\frac{27{b}^{4}}{a-b}$mol3•L-3;
(5)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是分解、B是正极,电子从负极流向阴极,所以电子从A流向D,故答案为:A→D;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故答案为:C6H6+6H++6e-=C6H12;
③阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气转移电子的物质的量=2.8mol×4=11.2mol,
生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量=$\frac{10mol×24%-x}{10mol-3xmol+5.6mol}$=10%,
x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则$\frac{7.2mol}{11.2mol}$×100%=64.3%,故答案为:64.3%.
点评 本题考查较综合,涉及氧化还原反应的计算、化学平衡计算、电化学原理等,把握化学反应原理为解答的关键,侧重分析、应用能力的考查,题目难度中等.

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案| A. | 上述元素中,Y的原子半径最大 | |
| B. | 上述元素中,W的气态氢化物最稳定 | |
| C. | 元素W和X可形成含有极性键的极性分子WX3 | |
| D. | 工业上可用电解熔融的Y、Z的化合物的方法冶炼Y、Z的单质 |
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
| A. | 可利用废油脂制肥皂 | |
| B. | 袋装食品常用生石灰包作为食品的抗氧化剂 | |
| C. | 配制CuSO4溶液时加入少量的稀硫酸 | |
| D. | 用钠和钠的化合物做焰色反应实验,焰色均为黄色 |
| 反应时间/min | n(H2)/mol | n(I2)/mol |
| 0 | 0.9 | 0.3 |
| t1 | 0.8 | |
| t2 | 0.2 |
| A. | 反应在t1 min内的平均速率为:v(H2)=$\frac{0.1}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变 | |
| C. | 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol | |
| D. | 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应 |
| 选项 | 操作和现象 | 结论 |
| A | CH4和Cl2混合于试管中光照,颜色逐渐褪去 | 二者发生了化合反应 |
| B | 微热滴有2滴酚酞的饱和NaHCO3溶液,溶液颜色加深 | NaHCO3受热分解生成了Na2CO3 |
| C | 向淀粉溶液中加入20%的硫酸,加热几分钟,冷却后再加入银氨溶液,水浴,没有银镜生成 | 淀粉没发生水解 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸,观察到试管口有红棕色气体产生 | 酸性环境下,NO3-被Fe2+还原为NO,NO遇氧气生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | lH、2H、3H为同素异形体 | B. | lH、2H、3H互为同位素 | ||
| C. | lH、2H、3H的质量数相同 | D. | lH、2H、3H为同分异构体 |
| A. | CuSO4 | B. | Fe2(SO4)3 | C. | 稀HNO3 | D. | Al2(SO4)3 |
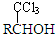 (-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾
(-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾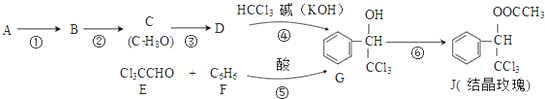
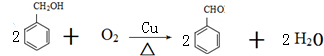 .
.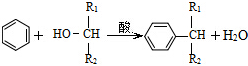 ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.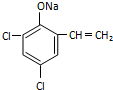 或
或 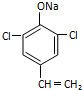 (只写一种).
(只写一种).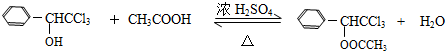 .
.