题目内容
6.下列说法正确的是( )| A. | 鸡蛋清溶液中加入醋酸铅溶液,会发生盐析 | |
| B. | 青苹果中富含苹果酸,因此苹果是酸性食物 | |
| C. | 过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源 | |
| D. | 氢氧化钠、碳酸钙、氢氧化铝等可作为抗酸药 |
分析 A.鸡蛋清的成分是蛋白质,蛋白质遇重金属盐发生变性;
B.在人体内产生碱性物质的称为碱性食品,如:蔬菜、水果,茶叶等;
C.过氧化钠和人呼出的二氧化碳和水蒸气反应生成氧气;
D.胃药的成分是能跟盐酸起反应的物质,可以减少胃中盐酸的含量,反应生成物应无毒,强碱具有很强的腐蚀性,不宜做胃药.
解答 解:A.鸡蛋清的成分是蛋白质,醋酸铅为重金属盐,醋酸铅可使蛋白质变性,而不是盐析,故A错误;
B.青苹果中富含苹果酸,但苹果是碱性食物,故B错误;
C.过氧化钠和人呼出的二氧化碳和水蒸气反应生成氧气,过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源,故C正确;
D.氢氧化钠具有强腐蚀性,不宜做胃药,故D错误.
故选C.
点评 本题考查了物质的性质与用途,难度不大,注意生活中注意理论联系实际.

练习册系列答案
相关题目
16.下列化学用语表达正确的有( )
①羟基的电子式: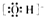
②次氯酸分子的结构式:H-O-Cl
③乙烯的最简式(实验式):CH2=CH2
④含有10个中子的氧原子:188O
⑤铝离子的结构示意图: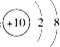
⑥二氧化碳分子的比例模型
①羟基的电子式:
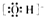
②次氯酸分子的结构式:H-O-Cl
③乙烯的最简式(实验式):CH2=CH2
④含有10个中子的氧原子:188O
⑤铝离子的结构示意图:
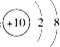
⑥二氧化碳分子的比例模型

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
17.下列说法错误的是( )
| A. | 可利用废油脂制肥皂 | |
| B. | 袋装食品常用生石灰包作为食品的抗氧化剂 | |
| C. | 配制CuSO4溶液时加入少量的稀硫酸 | |
| D. | 用钠和钠的化合物做焰色反应实验,焰色均为黄色 |
14.某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g)?2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):下列说法正确的是( )
| 反应时间/min | n(H2)/mol | n(I2)/mol |
| 0 | 0.9 | 0.3 |
| t1 | 0.8 | |
| t2 | 0.2 |
| A. | 反应在t1 min内的平均速率为:v(H2)=$\frac{0.1}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变 | |
| C. | 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol | |
| D. | 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应 |
1.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 选项 | 操作和现象 | 结论 |
| A | CH4和Cl2混合于试管中光照,颜色逐渐褪去 | 二者发生了化合反应 |
| B | 微热滴有2滴酚酞的饱和NaHCO3溶液,溶液颜色加深 | NaHCO3受热分解生成了Na2CO3 |
| C | 向淀粉溶液中加入20%的硫酸,加热几分钟,冷却后再加入银氨溶液,水浴,没有银镜生成 | 淀粉没发生水解 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸,观察到试管口有红棕色气体产生 | 酸性环境下,NO3-被Fe2+还原为NO,NO遇氧气生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
11.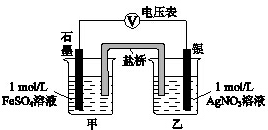 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
注:经检验黑色固体为Ag
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
18.氢元素有lH(氕)、2H(氘)、3H(氚)三种原子,下列说法正确的是( )
| A. | lH、2H、3H为同素异形体 | B. | lH、2H、3H互为同位素 | ||
| C. | lH、2H、3H的质量数相同 | D. | lH、2H、3H为同分异构体 |
15.关于下列各装置图(略去部分夹持仪器)的叙述中,正确的是( )
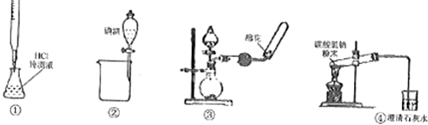

| A. | 利用装置①进行盐酸待测溶液浓度的测定 | |
| B. | 利用装置②分离碘酒中碘和酒精 | |
| C. | 利用装置③制备收集干燥氨气 | |
| D. | 利用装置④加热分解碳酸氢钠 |
10.可用来鉴别己烯、苯酚、甲苯、乙酸乙酯溶液的一组试剂是( )
| A. | 氯化铁溶液、溴水 | B. | 碳酸钠溶液、溴水 | ||
| C. | KMnO4酸性溶液、溴水 | D. | KMnO4酸性溶液、氯化铁溶液 |