题目内容
12.下列反应的离子方程式正确的是( )| A. | NaHCO3溶液与盐酸:CO32-+2 H+=H2O+CO2↑ | |
| B. | 硝酸银溶液与铜:Cu+Ag+=Cu2++Ag | |
| C. | 金属钾与水反应:K+H2O═K++OH-+H2↑ | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑ |
分析 A.碳酸氢根离子应保留,不能拆;
B.电荷不守恒;
C.原子个数不守恒;
D.醋酸与碳酸钙反应生成醋酸钙和二氧化碳、水.
解答 解:A.NaHCO3溶液与盐酸,离子方程式:HCO3-+H+=H2O+CO2↑,故A错误;
B.硝酸银溶液与铜,离子方程式:Cu+2Ag+=Cu2++2Ag,故B错误;
C.金属钾与水反应,离子方程式:2K+2H2O═2K++2OH-+H2↑,故C错误;
D.用醋酸除水垢,离子方程式:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式的拆分、原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
2.铝用来焊接钢轨是利用( )
| A. | 铝同氧气反应生成稳定的保护层 | B. | 铝是热的良导体 | ||
| C. | 铝是强还原剂,铝热反应放热 | D. | 铝合金强度大 |
3.根据下列有关图象判断,下列说法正确的是( )


| A. | 由图象Ⅰ可知,该反应在T1、T3处达到平衡 | |
| B. | 由图象Ⅰ可知,该反应的△H>0 | |
| C. | 图象Ⅱ发生反应的化学方程式为2X+6Y?3Z | |
| D. | 由图象Ⅱ可知,相同条件下起始时投入0.1mol•L-1 Y、0.3mol•L-1 Z和0.4mol•L-1 Z反应,达到平衡后,Z的浓度为0.4mol•L-1 |
20.X元素的一个原子失去两个电子转移到Y元素的两个原子中去,形成离子化合物Z,下列说法中错误的是( )
| A. | Z可以电离 | B. | Z可以表示为:XY2 | C. | X形成+2价阳离子 | D. | Z的电子式为 |
7.某金属A不溶于冷的浓硝酸,A与银用导线连接后浸入硫酸溶液,所组成的原电池中电流由银极通过导线流回A极,则A可能是( )
| A. | Pt | B. | Cu | C. | Zn | D. | Al |
17.按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是( )
| A. | Fe | B. | Mg | C. | P | D. | Na |
1.下列化学用语不能正确解释相关事实的是( )
| A. | 碱性氢氧燃料电池的正极反应:H2-2e-+2OH-═2H2O | |
| B. | 用电子式表示NaCl的形成过程: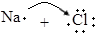 →Na+[ →Na+[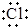 ]- ]- | |
| C. | 少量二氧化硫通入次氯酸钠碱性溶液中:SO2+C1O一+2OH-═SO42-+Cl-+H2O | |
| D. | 汽车尾气系统的催化转化器可降低NO等的排放:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2 |

 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题: