题目内容
2.现有下列十二种物质:①NH3 ②Na2O2 ③Ba(OH)2 ④CO2 ⑤H2SO4 ⑥NaOH ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3⑪NH4Cl⑫H2O2(1)按物质的分类方法填写下列的空白处:
电解质②③⑤⑥⑩⑪⑫
非电解质①④
既含有离子键又含有共价键的化合物②③⑥⑩⑪
既含有极性键又含有非极性键的化合物:⑫
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反
应对应的化方程式(写一个)为:2NaOH+H2SO4═Na2SO4+2H2O
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-
(4)17.1g ⑩溶于水配成250mL溶液,SO42-的物质的量浓度为0.6mol/L.
分析 (1)水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质;一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键;由不同非金属原子之间形成的为极性共价键,由相同非金属原子形成的共价键为非极性共价键,以此来解答.
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-═H2O;是强酸强碱的中和反应;
(3)硫酸铝是强电解质水溶液中完全电离;
(4)17.1g硫酸铝换算物质的量根据C=$\frac{n}{v}$计算浓度.
解答 解:(1):①NH3溶于水生成一水合氨导电,但是氨气分子本身不能电离,属于非电解质;含有N-H极性键;
②Na2O2熔融状态下能够导电,属于电解质,钠离子和过氧根离子构成,属于离子化合物,含有离子键、过氧根离子中含有氧氧非极性键;
③Ba(OH)2 熔融状态下能够导电,属于电解质,钡离子和氢氧根离子构成,属于离子化合物,含有离子键、氢氧根离子中含有氢氧极性键;
④CO2 溶于水生成碳酸溶液导电,但是二氧化碳分子本身不能电离,属于非电解质,碳和氧之间存在极性键;
⑤H2SO4在水溶液中能电离出H+和SO42-能导电是电解质,氢和氧之间、硫和氧之间存在极性键;
⑥NaOH为离子化合物,在水溶液中或熔融状态下能导电是电解质,氢和氧之间存在极性键,钠离子和氢氧根离子之间存在离子键;
⑦红褐色的氢氧化铁液体为混合物,既不是电解质也不是非电解质;
⑧氨水为为氨气的水溶液属于混合物,既不是电解质也不是非电解质;
⑨稀硝酸为硝酸的溶液为混合物,既不是电解质也不是非电解质;
⑩Al2(SO4)3水溶液中或熔融状态下能够电离出硫酸根离子和铝离子导电,属于电解质,铝离子和硫酸根离子间存在离子键,硫和氧之间存在极性共价键;
⑪NH4Cl水溶液中能够电离出氯离子和铵根离子导电,属于电解质,铵根离子和氯离子间存在离子键,氮和氢之间存在极性共价键;
⑫H2O2氧和氢之间存在极性共价键,氧和氧之间存在非极性共价键,在水溶液中微弱电离,属于电解质;
故答案为:②③⑤⑥⑩⑪⑫;①④;②③⑥⑩⑪;⑫;
(2)上述十二种物质中有两种物质之间可发生离子反应:H++OH-═H2O,是强酸强碱的中和反应;该离子反应对应的化学方程式如:2NaOH+H2SO4═Na2SO4+2H2O,
故答案为:2NaOH+H2SO4═Na2SO4+2H2O;
(3)Al2(SO4)3在水中完全电离是强电解质,电离方程式为:Al2(SO4)3=2Al3++3SO42-,
故答案为:Al2(SO4)3=2Al3++3SO42-;
(4)17.1g硫酸铝物质的量=$\frac{17.1g}{342g/mol}$=0.05mol;溶于水配成250mL溶液溶质浓度C=$\frac{n}{v}$=$\frac{0.05mol}{0.25L}$=0.2mol/L;则C(SO42-)=0.6mol/L,
故答案为:0.6mol/L.
点评 本题考查了电解质、非电解质、化学键的判断、离子方程式的书写、物质的量的有关计算,题目难度不大,注意硫酸铝的电离以及相关计算公式的熟练应用.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | KSCN | B. | NH3•H2O | C. | NaOH溶液 | D. | H2S溶液 |
| A. | 碘水--过量氢氧化钠溶液--氢氧化铜的悬浊液 | |
| B. | 硫酸溶液--碘水--过量氢氧化钠溶液--氢氧化铜的悬浊液 | |
| C. | 硫酸溶液--过量氢氧化钠溶液--碘水--氢氧化铜的悬浊液 | |
| D. | 硫酸溶液--碘水--氢氧化铜的悬浊液 |
| A. | 臭氧层中氟利昂释放出的氯原子是O3分解的催化剂 | |
| B. | 高压放电条件下O2可以转化成O3 | |
| C. | t℃时,3O2(g)?2O3(g),K≈3.33×10-77 | |
| D. | 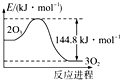 O3转变为O2能量曲线可用图表示 |
| A. | 光导纤维的主要成分是二氧化硅,其主要原理是二氧化硅具有较好的导光性 | |
| B. | 盐卤点豆腐、明矾净水与胶体的性质有关 | |
| C. | 新型禽流感病毒H5N1型病毒致死率高,通过高温条件下可杀死H5N1型禽流感病毒 | |
| D. | 雾霾成为现代生活中主要的污染之一,其中PM2.5指标指的是分散质直径在2.5nm的微粒 |
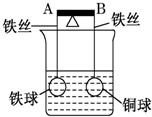 如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)
如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)
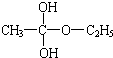 再转化为酯和水,以上反应均为可逆反应,回答下列问题:
再转化为酯和水,以上反应均为可逆反应,回答下列问题: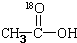 进行该实验,18O可存在于哪些物质中A、C
进行该实验,18O可存在于哪些物质中A、C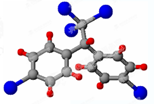 按要求完成下列问题:
按要求完成下列问题: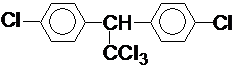 ;
;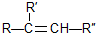 在一定条件下氧化可得产物
在一定条件下氧化可得产物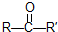 和
和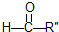 .某烃1mol在一定条件下氧化得到产物
.某烃1mol在一定条件下氧化得到产物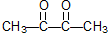 和OHCCH2CH2CHO各1mol.这种烃的结构简式是
和OHCCH2CH2CHO各1mol.这种烃的结构简式是 .
.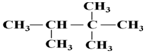 :2,2,3-三甲基丁烷;
:2,2,3-三甲基丁烷;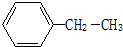 乙苯
乙苯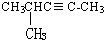 4-甲基-2-戊炔.
4-甲基-2-戊炔.