题目内容
11.O3是重要的氧化剂和水处理剂,在平流层存在:2o3?3O2,2O3?O+O2.粒子X能加速O3的分解:X+O3?XO+O2;XO+O═X+O2(X=Cl、Br、NO等).已知:2O3(g)?3O2(g)△H=-144.8 kJ.mol-1t℃时K=3×1026.下列说法不正确的是( )| A. | 臭氧层中氟利昂释放出的氯原子是O3分解的催化剂 | |
| B. | 高压放电条件下O2可以转化成O3 | |
| C. | t℃时,3O2(g)?2O3(g),K≈3.33×10-77 | |
| D. | 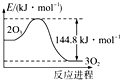 O3转变为O2能量曲线可用图表示 |
分析 A.根据催化剂是能改变其他物质的化学反应速率,且参与化学反应,但本身的质量和化学性质在反应前后不变的物质;
B.根据压强增大,平衡向物质的量减小的方向移动;
C.相同条件下,逆反应的K值是正反应K值的倒数.
D.根据吸热反应,△H>0,放热反应,△H<0以及反应物的总能量大于生成物的总能量,反应放热,反应热=反应物的总能量-生成物的总能量.
解答 解:A.粒子X能加速O3的分解:X+O3=XO+O2;XO+O=X+O2(X=Cl、Br、NO、OH等),X参与反应,加快了速率,本身的质量和化学性质在反应前后不变,属于催化剂,所以氟利昂在紫外线的照射下分解的氯原子在此转化过程中作为催化剂,故A正确;
B.高压放电条件下,压强增大,平衡向物质的量减小的方向移动,O2可以转化成O3,故B正确;
C.逆反应的K值是正反应K值的倒数,所以3O2(g)?2O3(g),K=$\frac{1}{3×1{0}^{76}}$=3.33×10-77,故C正确;
D.根据2O3(g)?3O2(g)△H=-144.8kJ/mol,可知反应为放热反应,而图象表示表示的也是放热,但反应热的数值不等于144.8,故D错误;
故选:D.
点评 本题考查催化剂、平衡移动、放热反应的图象与含义、平衡常数等,难度不大,注意相同条件下,逆反应的K值是正反应K值的倒数.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
1.下列物质中:互为同分异构体的是( )
| A. | 液氯、氯气 | B. | CH2=CH-CH3 CH3-CH2-CH3 | ||
| C. | N2、CO | D. | 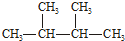 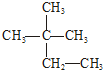 |
19.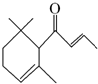 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 1 mol该化合物完全燃烧消耗19 mol O2 | |
| D. | 与足量溴水加成,最多消耗Br22 mol |
6.对相对分子质量为128的烃的下列说法,正确的组合是( )
①可能是芳香烃 ②可能是苯的同系物③分子中不可能都是单键 ④分子中可能都是单键.
①可能是芳香烃 ②可能是苯的同系物③分子中不可能都是单键 ④分子中可能都是单键.
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | 只有①④ |
3.对可逆反应平衡:A(g)+3B(g)?2C(g)△H<0,下列叙述错误的是( )
| A. | 升高温度,v(正)、v(逆)都增大,但v(正)增的更大 | |
| B. | 增大压强,v(正)、v(逆)都增大,但v(正)增的更大 | |
| C. | 增大A的浓度,v(正)会增大,但v(逆)会减小 | |
| D. | 采用适当催化剂(正),v(正)、v(逆)同时增大,而且增大的倍数相同 |
20.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
若总反应平衡后,要提高CO的转化率,可以采取的措施是ce(填字母代号)
a.升温 b.加催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下平衡常数为400.此温度下,在密闭容器中加入CH3OH,某时刻测得各组分的浓度如表:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(5)2H2+CO?CH3OH的催化剂为Cu2O,据研究,需要向反应体系中额外加入少量CO2,原因是:Cu2O+CO?2Cu+CO2(用化学方程式表示).
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
若总反应平衡后,要提高CO的转化率,可以采取的措施是ce(填字母代号)
a.升温 b.加催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下平衡常数为400.此温度下,在密闭容器中加入CH3OH,某时刻测得各组分的浓度如表:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(5)2H2+CO?CH3OH的催化剂为Cu2O,据研究,需要向反应体系中额外加入少量CO2,原因是:Cu2O+CO?2Cu+CO2(用化学方程式表示).
1.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠电子式:Na${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$Na | |
| B. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子结构示意图: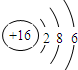 | |
| D. | 乙烯的结构简式:C2H4 |
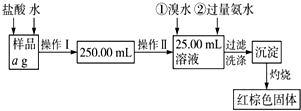 某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题:
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:请根据流程,回答以下问题: