题目内容
10.能用来分离Fe3+和Al3+离子的试剂是( )| A. | KSCN | B. | NH3•H2O | C. | NaOH溶液 | D. | H2S溶液 |
分析 二者离子都不和酸反应,都能和碱反应,但氢氧化铝能溶于强碱溶液,氢氧化铁不溶于强碱溶液,据此分析解答.
解答 解:A.铁离子和KSCN溶液生成络合物而导致溶液呈血红色,铝离子和KSCN溶液不反应,但硫氰化铁和铝离子仍然混溶,不能分离,只能鉴别,故A错误;
B.两种离子都和一水合氨反应生成氢氧化物沉淀,所以不能分离,故B错误;
C.Fe3+和NaOH反应生成Fe(OH)3红褐色沉淀,Al3+和少量NaOH溶液反应生成氢氧化铝沉淀,和过量NaOH溶液反应生成可溶性的NaAlO2,然后采用过滤方法分离,所以可以用NaOH溶液分离Fe3+和Al3+离子,故C正确;
D.Fe3+和H2S发生氧化还原反应生成Fe2+和S,Al3+离子和H2S发生不反应,故D错误;
故选C.
点评 本题考查离子的分离,侧重考查元素化合物知识,明确离子的性质及离子性质的差异性是解本题关键,易错选项是D,注意:铁离子和氢硫酸发生氧化还原反应,氢氧化铝能溶于强碱但不能溶于弱碱,题目难度不大.

练习册系列答案
相关题目
20. 在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
 在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )
在容积一定的密闭容器中,可逆反应:A2 (g)+B2(g)?xC(g) 符合下列图Ⅰ所示关系.由此推断,对图Ⅱ的说法正确的是( )| A. | P3>P4,Y轴表示混合气体的平均摩尔质量 | |
| B. | P3>P4,Y轴表示混合气体的密度 | |
| C. | P3<P4,Y轴表示A2的浓度 | |
| D. | P3<P4,Y轴表示A2的转化率 |
1.下列物质中:互为同分异构体的是( )
| A. | 液氯、氯气 | B. | CH2=CH-CH3 CH3-CH2-CH3 | ||
| C. | N2、CO | D. | 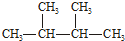 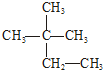 |
18.以下转化不能通过一步反应实现的是( )
| A. | SiO2→SiF4 | B. | Al2O3→Al(OH)3 | C. | Fe→FeCl2 | D. | SiO2→CaSiO3 |
5.如图体现了无催化剂参与反应过程的能量变化图.下列有关说法正确的是( )
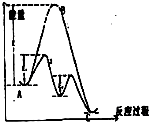

| A. | 使用正催化剂能够加快反应的速率,根本上是由于催化剂参与反应,并且同等程度地降低了正逆反应的活化能 | |
| B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑△H>0,该反应过程可用该图象表示 | |
| C. | 使用催化剂不仅能加快反应速率,而且可以让不可能发生的反应发生,如利用催化技术处理汽车尾气:2CO+2NO═2CO2+N2 | |
| D. | 化学反应的本质是旧键断裂,新键形成,如图可知反应的能量变化由旧键断裂释放的能量和新键形成吸收的能量大小决定 |
19.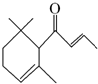 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
 一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物αdamascone可用于制作“香水”,其结构为:有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 1 mol该化合物完全燃烧消耗19 mol O2 | |
| D. | 与足量溴水加成,最多消耗Br22 mol |
20.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
若总反应平衡后,要提高CO的转化率,可以采取的措施是ce(填字母代号)
a.升温 b.加催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下平衡常数为400.此温度下,在密闭容器中加入CH3OH,某时刻测得各组分的浓度如表:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(5)2H2+CO?CH3OH的催化剂为Cu2O,据研究,需要向反应体系中额外加入少量CO2,原因是:Cu2O+CO?2Cu+CO2(用化学方程式表示).
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
若总反应平衡后,要提高CO的转化率,可以采取的措施是ce(填字母代号)
a.升温 b.加催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下平衡常数为400.此温度下,在密闭容器中加入CH3OH,某时刻测得各组分的浓度如表:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(5)2H2+CO?CH3OH的催化剂为Cu2O,据研究,需要向反应体系中额外加入少量CO2,原因是:Cu2O+CO?2Cu+CO2(用化学方程式表示).