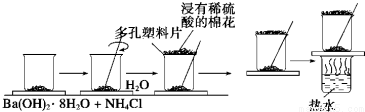
题目内容
12.下表是元素周期表的一部分,用元素符号或化学式填空回答:| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 二 | ⑪ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)写出①元素的单质分子的电子式
 ;用电子式表示元素②与⑪化合物的形成过程
;用电子式表示元素②与⑪化合物的形成过程 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.(3)碱性最强的化合物的电子式是:
 ;
;(4)②元素氢化物在常温下和③发生反应所得溶液的pH>7
(5)元素③与 ⑩形成化合物的化学式是NaCl,高温灼烧该化合物时,火焰呈黄色.
(6)元素⑦与⑩两者核电荷数之差是18.
(7)比较元素⑦、⑨、⑩原子的半径大小K>Br>Cl
(8)③④⑤单质的活泼性顺序为:Na>Mg>Al(从大到小,判断的实验依据是:与酸反应的剧烈程度(任写一种)
(9)请设计一个实验方案,比较⑦和⑩单质氧化性的强弱:Cl2+2Br-=Br2+2Cl-.
分析 由元素在周期表中的位置可知①~⑪分别为N、O、Na、Mg、Al、S、Cl、Ar、K、Br、C,
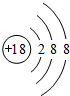
(1)化学性质最不活泼的原子为Ar;
(2)①元素的单质为氮气;②与⑪形成的化合物为CO2,为共价化合物;
(3)碱性最强的化合物为KOH;
(4)②元素氢化物为水,在常温下和③发生反应所得溶液为氢氧化钠溶液;
(5)元素③与 ⑩形成化合物为NaCl;
(6)元素⑦与⑩分别为Cl和Br,原子序数分别为17、35;
(7)同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
(8)同周期元素从左到右元素的金属性逐渐减弱,单质的活泼性逐渐减弱;
(9)可根据单质之间的置换反应判断.
解答 解:由元素在周期表中的位置可知①~⑪分别为N、O、Na、Mg、Al、S、Cl、Ar、K、Br、C,
(1)化学性质最不活泼的原子为Ar,原子核外有3个电子层,最外层电子数为8,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)①元素的单质为氮气,电子式为 ;②与⑪形成的化合物为CO2,形成过程为
;②与⑪形成的化合物为CO2,形成过程为 ,为共价化合物,
,为共价化合物,
故答案为: ;
; ;共价;
;共价;
(3)碱性最强的化合物为KOH,电子式为 ,故答案为:
,故答案为: ;
;
(4)②元素氢化物为水,在常温下和③发生反应所得溶液为氢氧化钠溶液,pH大于7,故答案为:>;
(5)元素③与 ⑩形成化合物为NaCl,焰色反应呈黄色,故答案为:NaCl;黄;
(6)元素⑦与⑩分别为Cl和Br,原子序数分别为17、35,两者核电荷数之差是18,故答案为:18;
(7)同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径K>Br>Cl,故答案为:K>Br>Cl;
(8)同周期元素从左到右元素的金属性逐渐减弱,单质的活泼性逐渐减弱,则活泼性顺序为Na>Mg>Al,可根据与酸反应的剧烈程度判断,
故答案为:Na>Mg>Al;与酸反应的剧烈程度;
(9)氧化性强的单质氯气单质可以将氧化性弱的单质溴单质从其盐中置换出来,即Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-.
点评 本题考查了元素周期表和元素周期律综合应用,根据原子结构、物质结构及物质性质、元素周期律等知识来分析解答,熟练掌握并灵活运用元素周期律知识,题目难度不大.

| A. | 灼烧蚕丝织物有特殊气味 | |
| B. | 女士服用维C美容是利用维C的氧化性 | |
| C. | 将碘酒滴在土豆片上,可观察到蓝色 | |
| D. | 利用油脂在碱性条件下的水解,可以制肥皂 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | A | |||||||
| 二 | D | F | H | |||||
| 三 | B | C | E | G |
(1)单质中氧化性最强的是F2,其电子式是
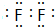 ;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是
;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是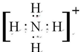 .
.(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOHAl(OH)3H3PO4HClO4;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式
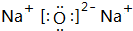 ,
,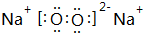 .其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
.其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移. | A. | CH2=C(CH2CH3)C (CH3)3 | B. | CH2=C(CH3)C(CH3)2CH2CH3 | ||
| C. | HC≡CCH(CH3)C(CH3)3 | D. | (CH3)3CC(CH3)=CHCH3 |
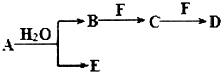 A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答)
A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答) ;D的化学式为NaHCO3.
;D的化学式为NaHCO3.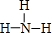 ,D属于共价化合物(填“共价”或“离子”);
,D属于共价化合物(填“共价”或“离子”);