题目内容
13.NaHSO3被用于棉织物及有机物的漂白以及在染料、造纸、制革等工业中用作还原剂.(1)NaHSO3可由NaOH溶液吸收SO2制得.
2NaOH(aq)+SO2(g)=Na2SO3(aq)+H2O(l)△H1
2NaHSO3(aq)=Na2SO3(aq)+SO2 (g)+H2O(l)△H2
则反应SO2 (g)+NaOH(aq)=NaHSO3(aq) 的△H3=$\frac{△{H}_{1}-△{H}_{2}}{2}$(用含△H1、△H2式子表示);且△H1<△H2(填“>”、“<”和“=”).
(2)NaHSO3在不同温度下均可被KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图1.
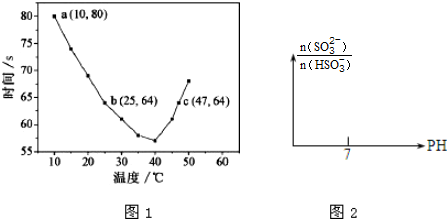
①a点时,v(NaHSO3)=5.0×10-5mol•L-1•s-1mol•L-1•s-1.
②根据图中信息判断反应:I2+淀粉?蓝色溶液的△H<0(填“>”、“<”或“=”).
③10-40℃区间内,显色时间越来越短,其原因是10-40℃时,温度升高,NaHSO3和KIO3反应的
速率加快,显色时间减小.
(3)已知:T℃时H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;NaHSO3溶液pH<7.在T℃时,往NaOH溶液中通入SO2.
①在NaHSO3溶液中加入少量下列物质后,$\frac{c({H}_{2}S{O}_{3})}{c(HS{O}_{3}^{-})}$的值增大的是BC.
A.H2OB.稀H2SO4 C.H2O2溶液D.NaOH溶液
②某时刻,测得溶液的pH=6,则此时,$\frac{n(HS{O}_{3}^{-})}{n(S{O}_{3}^{2-})}$=10.
③请在图2画出从开始通入SO2直至过量时,溶液中n(SO32-):n(HSO3-)随pH的变化趋势图
 .
.
分析 (1)①2NaOH(aq)+SO2(g)=Na2SO3(aq)+H2O(l)△H1
②2NaHSO3(aq)=Na2SO3(aq)+SO2 (g)+H2O(l)△H2
由盖斯定律:$\frac{1}{2}$(①-②)得到反应SO2 (g)+NaOH(aq)=NaHSO3(aq),据此计算;根据SO2 (g)与NaOH(aq)为化合反应,属于放热反应分析;
(2)①混合后NaHSO3的浓度为0.020mol•L-1×$\frac{10}{50}$=0.0040mol/L,反应所用时间为80min,根据v=$\frac{△c}{t}$计算;
②10~55℃间溶液变蓝,55℃时未观察到溶液变蓝,说明升高温度平衡逆移;
③根据温度对速率的影响分析;
(3)①NaHSO3中存在水解平衡HSO3-+H2O?H2SO3+OH-,其平衡常数为K=$\frac{c({H}_{2}S{O}_{3})•c({OH}^{-})}{c(HS{{O}_{3}}^{-})}$,K为常数保持不变,根据c(OH-)变化分析;
②NaHSO3中存在电离平衡HSO3-?SO32-+H+,根据亚硫酸的K2计算;
③2NaOH+SO2=Na2SO3+H2O,Na2SO3+H2O+SO2=2NaHSO3,溶液中碱性越强,则SO32-的浓度越大.
解答 解:(1)①2NaOH(aq)+SO2(g)=Na2SO3(aq)+H2O(l)△H1
②2NaHSO3(aq)=Na2SO3(aq)+SO2 (g)+H2O(l)△H2
由盖斯定律:$\frac{1}{2}$(①-②)得到反应SO2 (g)+NaOH(aq)=NaHSO3(aq)△H3=$\frac{1}{2}$(△H1-△H2)=$\frac{△{H}_{1}-△{H}_{2}}{2}$;
SO2 (g)与NaOH(aq)的反应为化合反应,属于放热反应,即$\frac{△{H}_{1}-△{H}_{2}}{2}$<0,所以△H1<△H2;
故答案为:$\frac{△{H}_{1}-△{H}_{2}}{2}$;<;
(2)①混合后NaHSO3的浓度为0.020mol•L-1×$\frac{10}{50}$=0.0040mol/L,反应所用时间为80min,则v=$\frac{△c}{t}$=$\frac{0.0040mol/L}{80min}$=5.0×10-5mol•L-1•s-1;
故答案为:5.0×10-5mol•L-1•s-1;
②10~55℃间溶液变蓝,55℃时未观察到溶液变蓝,说明升高温度I2+淀粉?蓝色溶液的平衡逆移,所以正方向为放热方向,即△H<0;
故答案为:<;
③升高温度反应速率加快,所以变色时间减小,即10-40℃时,温度升高,NaHSO3和KIO3反应的速率加快,显色时间减小;
故答案为:10-40℃时,温度升高,NaHSO3和KIO3反应的速率加快,显色时间减小;
(3)①NaHSO3中存在水解平衡HSO3-+H2O?H2SO3+OH-,其平衡常数为K=$\frac{c({H}_{2}S{O}_{3})•c({OH}^{-})}{c(HS{{O}_{3}}^{-})}$,K为常数保持不变,
A.加H2O溶液的pH增大,则c(OH-)增大,所以$\frac{c({H}_{2}S{O}_{3})}{c(HS{O}_{3}^{-})}$的值减小,故A错误;
B.加稀H2SO4 溶液的pH减小,则c(OH-)减小,所以$\frac{c({H}_{2}S{O}_{3})}{c(HS{O}_{3}^{-})}$的值增大,故B正确;
C.H2O2溶液与HSO3-反应生成NaHSO4,溶液的酸性增强,则c(OH-)减小,所以$\frac{c({H}_{2}S{O}_{3})}{c(HS{O}_{3}^{-})}$的值增大,故C正确;
D.加NaOH溶液,溶液的pH增大,则c(OH-)增大,所以$\frac{c({H}_{2}S{O}_{3})}{c(HS{O}_{3}^{-})}$的值减小,故D错误;
故答案为:BC;
②NaHSO3中存在电离平衡HSO3-?SO32-+H+,亚硫酸的K2=$\frac{c(S{{O}_{3}}^{2-})•c({H}^{+})}{c(HS{{O}_{3}}^{-})}$=1.0×10-7,则$\frac{n(HS{O}_{3}^{-})}{n(S{O}_{3}^{2-})}$=$\frac{1.0×1{0}^{-6}}{1.0×1{0}^{-7}}$=10,故答案为:10;
③往NaOH溶液中通入SO2至过量,溶液中发生的反应为:2NaOH+SO2=Na2SO3+H2O,Na2SO3+H2O+SO2=2NaHSO3,溶液中碱性越强,则SO32-的浓度越大,所以n(SO32-):n(HSO3-)随pH的增大而增大,其变化图为: ,故答案为:
,故答案为: .
.
点评 本题考查了盖斯定律的应用、反应速率的计算、化学平衡移动、弱电解质的电离和盐的水解平衡等,题目涉及的知识点较多,侧重于基础知识的综合应用考查,注意根据电离平衡和水解平衡常数分析解答.

| A. | CH2=C(CH2CH3)C (CH3)3 | B. | CH2=C(CH3)C(CH3)2CH2CH3 | ||
| C. | HC≡CCH(CH3)C(CH3)3 | D. | (CH3)3CC(CH3)=CHCH3 |
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答)
A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答)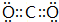 ;D的化学式为NaHCO3.
;D的化学式为NaHCO3. ,D属于共价化合物(填“共价”或“离子”);
,D属于共价化合物(填“共价”或“离子”);
 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验. →
→ .
.