题目内容
11.硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4•SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用.在实验室,浓硫酸是常用的干燥剂.完成下列计算:
(1)焦硫酸(H2SO4•SO3)溶于水,其中的SO3都转化为硫酸.若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为1.25mol/L.
(2)将1.95g锌加入到12.00mL 18.4mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000mL,取出15.00mL,
以酚酞为指示剂,用0.25mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70mL.通过计算确定浓硫酸被还原的产物是S.
(3)硫铁矿是工业上制硫酸的主要原料.硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量各为多少?
闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2.ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸.计算回答下列问题(计算保留2位小数)
(4)取1.56g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32g,样品中含硫化锌的质量分数是多少?生产10吨98%的浓硫酸需要这种矿石多少吨?(反应过程中硫损失2%)
分析 (1)根据公式c=$\frac{n}{V}$,来求硫酸的物质的量浓度;
(2)消耗的硫酸的物质的量是0.012L×18.4mol/L-0.18mol=0.0408mol.设硫酸的还原产物中,硫元素的化合价是n,金属锌的物质的量是:$\frac{1.95g}{65g/mol}$=0.03mol,生成硫酸锌的物质的量是0.03mol,所以0.03mol的硫酸显示酸性,根据电子守恒和化合价变化之间的关系来计算;
(3)设Fe3O4与Fe2O3物质的量分别为amol,bmol然后铁守恒和消耗氧气的量列方程组解;
(4)闪锌矿(主要成份为ZnS)在空气中高温加热闪锌矿生成ZnO和SO2,根据固体质量差量法来计算即可,依据硫元素守恒结合反应过程中的定量关系计算得到,反应的关系式为:S~ZnS~SO2~SO3~H2SO4;
解答 解:(1)n(H2SO4)=2n(H2SO4•SO3)=$\frac{445g}{178g/mol}$×2=5mol,所以该硫酸的物质的量浓度为c(H2SO4)=$\frac{5mol}{4.00L}$=1.25mol/L,故答案为:1.25mol/L;
(2)取1.95g锌加入到12.00mL18.4mol/L的浓硫酸中(反应中只生成一种还原产物),消耗的硫酸的物质的量是0.012L×18.4mol/L-0.18mol=0.0408mol.设硫酸的还原产物中,硫元素的化合价是n,金属锌的物质的量是:$\frac{1.95g}{65g/mol}$=0.03mol,生成硫酸锌的物质的量是0.03mol,所以0.03mol的硫酸显示酸性,根据电子守恒:$\frac{1.95g}{65g/mol}$×(2-0)=(0.0408mol-0.03mol)×(6-n),解得n=0,所以浓硫酸被还原的产物是硫单质,
故答案为:S;
(3)2934.4L氧气的物质的量为$\frac{2934.4L}{22.4L/mol}$=131mol,设Fe3O4与Fe2O3物质的量分别为amol,bmol,则3a+2b=48 8a+$\frac{11}{2}$b=131,解得:a=4 b=18,所以Fe3O4物质的量为4mol,Fe2O3物质的量为18mol,
答:反应产物中Fe3O4与Fe2O3物质的量为:Fe3O44 mol,Fe2O3,18 mol;
(4)设ZnS的质量是x,则2ZnS+3O2=2ZnO+2SO2 减少的固体质量
194 161 32
x 1.56-1.32
即$\frac{194}{x}$=$\frac{32}{1.56-1.32}$,解得x=1.455g,
所以ZnS的质量分数=$\frac{1.455}{1.56}$×100%≈93%,
根据S元素守恒,利用关系式发计算,反应的关系式为:S~ZnS~SO2~SO3~H2SO4,
设制得98%的硫酸10t,需要矿石xt
S~ZnS~SO2~SO3~H2SO4
32 98
x×93%×$\frac{32}{97}$(1-2%) 10×98%
x=10.64t
答:样品中含硫化锌的质量分数是93%,生产10吨98%的浓硫酸需要这种矿石10.64吨;
点评 本题是一道关于元素以及化合物的计算题,多种解题思想:元素守恒、极限反应的灵活应用是解题的关键,难度大.

| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 0.1mol甲基中含有的电子数为NA | |
| C. | 2.8 g乙烯和聚乙烯的混合物中所含碳原子数为0.2NA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
| A. | CH2=CH2 | B. | C6H5OH | C. | 裂化汽油 | D. | 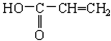 |
| A. | 紫色石蕊试液中通入二氧化硫,溶液先变红后褪色 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 金属钠 | 过滤 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 振荡、分液 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H2=-282.57kJ•mol-1
则C(s)+O2(g)═CO2(g);△H3为( )
| A. | +172.22 kJ•mol-1 | B. | -172.22 kJ•mol-1 | ||
| C. | +392.92 kJ•mol-1 | D. | -392.92 kJ•mol-1 |
| A. | COS分子是含有极性键的极性分子 | |
| B. | COS的电子式为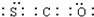 | |
| C. | COS分子中所有原子都满足8电子稳定结构 | |
| D. | COS属于离子化合物 |
| A. | NaHS溶液水解:HS-+H2O?S2-+H3O+ | |
| B. | 向Ca(C1O)2溶液中通入SO2:SO2+2ClO-+H2O=SO32-+2HClO | |
| C. | 硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42ˉ刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O |