题目内容
9.下列相关的离子方程式书写正确的是( )| A. | NaHS溶液水解:HS-+H2O?S2-+H3O+ | |
| B. | 向Ca(C1O)2溶液中通入SO2:SO2+2ClO-+H2O=SO32-+2HClO | |
| C. | 硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42ˉ刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O |
分析 A.硫氢化钠水解后溶液显示碱性,该反应为硫氢根离子的电离方程式;
B.二氧化硫具有还原性,能够被次氯酸根离子氧化成硫酸根离子;
C.离子个数配比不符合物质的化学式组成;
D.硫酸根离子刚好沉淀完全时,硫酸氢铵和氢氧化钡的物质的量之比为1:1.
解答 解:A.NaHS溶液显碱性,水解的离子方程式为:HS-+H2O?H2S+OH-,故A错误;
B.向次氯酸钙溶液通入少量SO2,反应生成硫酸钙沉淀,正确的离子方程式为:Ca2++2ClO?+SO2+H2O=CaSO4↓+2Cl?+2H+,故B错误;
C.硫酸与氢氧化钡溶液混合生成硫酸钡和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C错误;
D.NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全,二者的物质的量相等,反应的离子方程式为:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写方法判断,题目难度中等,主要考查氧化还原反应的离子反应判断、电荷守恒判断、定量反应的离子方程式的书写原则,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
12.甲、乙两烧杯分别装有100mL相同pH的氨水和氢氧化钠溶液,向其中各加入10mL 0.1mol/L AlCl3溶液,两烧杯中都有沉淀生成,下列判断错误的是( )
| A. | 两烧杯中的沉淀可能一样多 | |
| B. | 两烧杯中沉淀的最大可能值均为0.078g | |
| C. | 反应后两烧杯中溶液的pH可能:甲<乙 | |
| D. | 两烧杯中反应的离子方程式不同 |
4.6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.下列有关说法不正确的是( )
| X | Y | Z | |
| W | M | Q |
| A. | W的最高价氧化物可以和Z的氢化物反应 | |
| B. | X、Y、Z三种元素的原子半径由大到小的顺序为Z>Y>X | |
| C. | X的含10个电子的气态氢化物可以与X的最高价氧化物对应的水化物溶液反应生成盐 | |
| D. | 工业上电解Q元素的钠盐溶液可获得一种含Q元素的消毒剂 |
14.将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能含有乙烷 |
1.某有机物的结构简式为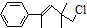 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 能使溴水褪色 | ||
| C. | 在一定条件下可以发生加聚反应 | D. | 一定条件下,能和NaOH醇溶液反应 |
18.下列元素一定为主族元素的是( )
| A. | 最外层有3个电子的元素 | B. | 最高正价为+7价的元素 | ||
| C. | 最外层电子数大于电子层数的元素 | D. | 内层电子数排满的原子 |
19.下列分子中,所有碳原子一定在同一平面上的是( )
| A. | CH3-CH2-CH2-CH3 | B. | CH3-CH═CH-CH2-CH3 | ||
| C. | 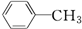 | D. | CH3-C≡C-CH3 |