题目内容
6.下列说法正确的是 ( )| A. | 紫色石蕊试液中通入二氧化硫,溶液先变红后褪色 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
分析 A、二氧化硫通入紫色石蕊试液发生反应生成亚硫酸显酸性,溶液变红色;
B、铜和浓硫酸加热发生反应;
C、硫和氧气只能生成二氧化硫,不能生成三氧化硫;
D、富含硫黄的矿物可以煅烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫溶于水生成硫酸;
解答 解:A、二氧化硫是酸性氧化物,通入紫色石蕊试液发生反应生成亚硫酸显酸性,溶液变红色不能褪色,故A错误;
B、铜和浓硫酸常温下不能发生反应,加热发生反应,不是铜的钝化,故B错误;
C、硫和氧气只能生成二氧化硫不能生成三氧化硫,生成的二氧化硫在催化剂作用下发生反应才能生成三氧化硫,故C错误;
D、富含硫黄的矿物可以煅烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫溶于水生成硫酸,可以制备硫酸,故D正确;
故选D.
点评 本题考查了二氧化硫性质分析判断,主要是对反应条件、反应产物的理解应用,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.化学反应是旧化学键断裂和新化学键形成的过程.氢气与氧气的反应中,破坏lmol氢氢键消耗的能量为Q1kJ、破坏1mol氧氧键消耗的能量为Q2kJ、形成lmol氢氧键释放的能量为Q3kJ.下列关系中正确的是( )
| A. | Ql+Q2<Q3 | B. | Ql+Q2>2Q3 | C. | 2Ql+Q2<4Q3 | D. | 2Ql+Q2>4Q3 |
17.下列关于有机物的叙述不正确的是( )
| A. | 甲烷、甲苯、乙醇、乙酸都可以发生取代反应 | |
| B. | 能发生银镜反应的有机物都是醛 | |
| C. | 乙酸乙酯在无机酸或碱存在时都能发生水解反应 | |
| D. | 可用浓溴水来区分乙醇和苯酚 |
14. 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
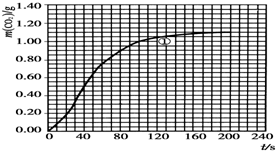
(2)实验①中CO2质量随时间变化的关系见图:
依据反应方程式$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O,计算实验①在70~90s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程).
 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格 (粗、细)对该反应速率 的影响. |
| ② | ||||
| ③ | ||||
| ④ |
依据反应方程式$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O,计算实验①在70~90s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程).
18.已知某含苯环的分子C8H10,苯环上有两个侧链,其一氯取代物的种数是(不考虑立体异构)( )
| A. | 10种 | B. | 9种 | C. | 6种 | D. | 5种 |
15.可逆反应2SO2+O2?2SO3达到平衡的标志是( )
①消耗2mol SO2的同时生成2mol SO3
②SO2、O2与SO3的物质的量之比为2:1:2
③反应混合物中,SO3的质量分数不再改变.
①消耗2mol SO2的同时生成2mol SO3
②SO2、O2与SO3的物质的量之比为2:1:2
③反应混合物中,SO3的质量分数不再改变.
| A. | ①② | B. | ①③ | C. | 只有③ | D. | 全部 |
4.6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.下列有关说法不正确的是( )
| X | Y | Z | |
| W | M | Q |
| A. | W的最高价氧化物可以和Z的氢化物反应 | |
| B. | X、Y、Z三种元素的原子半径由大到小的顺序为Z>Y>X | |
| C. | X的含10个电子的气态氢化物可以与X的最高价氧化物对应的水化物溶液反应生成盐 | |
| D. | 工业上电解Q元素的钠盐溶液可获得一种含Q元素的消毒剂 |
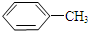 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$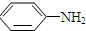

 ,G
,G .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. 与碳酸氢钠溶液反应:
与碳酸氢钠溶液反应: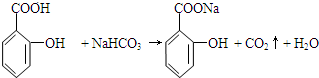 .
.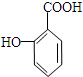 有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.
有多种同分异构体,其中属于芳香族化合物的同分异构体不可能为下列中的ad.