题目内容
1.浓硫酸具有 A.强酸性 B.强氧化性 C.脱水性 D.吸水性 E.高沸点、难挥发性以下过程主要表现了浓硫酸什么性质?将答案的字母添入括号中
(1)热的浓硫酸与铜片反应AB
(2)浓硫酸干燥氯气、氢气、氧气、SO2等气体D.
分析 (1)加热条件下,浓硫酸和Cu反应方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,该反应中S元素部分化合价不变、部分化合价由+6价变为+4价;
(2)浓硫酸具有吸水性,能作干燥剂.
解答 解:(1)加热条件下,浓硫酸和Cu反应方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,该反应中S元素部分化合价不变、部分化合价由+6价变为+4价,则浓硫酸体现酸性和强氧化性,故选AB;
(2)浓硫酸具有吸水性,能作氯气、氢气、氧气、SO2等气体的干燥剂,故选D.
点评 本题考查浓硫酸的性质,浓硫酸具有酸性、吸水性、脱水性和强氧化性,注意吸水性和脱水性区别,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
12.下列实验事实陈述ⅠⅡ正确并且有因果关系的是( )
| Ⅰ操作 | Ⅱ结论 | |
| A | 滴加BaC12溶液生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| D | 滴加氯水和CC14,振荡、静置.下层溶液显紫色 | 原溶液中有I- |
| A. | A | B. | B | C. | C | D. | D |
16.化学反应是旧化学键断裂和新化学键形成的过程.氢气与氧气的反应中,破坏lmol氢氢键消耗的能量为Q1kJ、破坏1mol氧氧键消耗的能量为Q2kJ、形成lmol氢氧键释放的能量为Q3kJ.下列关系中正确的是( )
| A. | Ql+Q2<Q3 | B. | Ql+Q2>2Q3 | C. | 2Ql+Q2<4Q3 | D. | 2Ql+Q2>4Q3 |
6.一定温度下(T1<T2),在三个体积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)═CH3OH(g)
下列说法正确的是( )
| 容器 编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CO | H2 | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0.18 |
| Ⅱ | T1 | 0.4 | 0.8 | |
| Ⅲ | T2 | 0.2 | 0.4 | 0.16 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达平衡时,容器Ⅰ中CH3OH(g)的体积分数比容器Ⅱ中的大 | |
| C. | 采取加压、增大c(H2)、加入合适的催化剂等措施,都能提高CO的转化率 | |
| D. | 若起始时向容器Ⅰ中充入CO 0.2 mol、H2 0.2 mol、CH3OH(g)0.5 mol,则反应将向正反应方向进行 |
10.如图是CO2电催化还原为CH4的工作原理示意图.正确的是( )
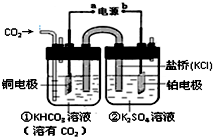

| A. | 该装置为原电池,其中a为正极 | |
| B. | 铜电极的电极反应式为:CO2+8H++8e-$?_{加热}^{催化剂}$CH4+2H2O | |
| C. | 反应开始后,电子从a极流出至铜电极,经电解质溶液到铂电极最后流回至b极 | |
| D. | 一段时间后,②池中溶液的pH一定下降 |
 ;
;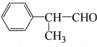 ,工业合成路线如下:
,工业合成路线如下: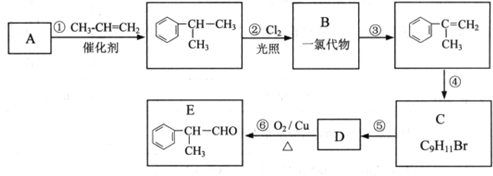
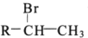
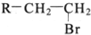 (R-代表烃基)
(R-代表烃基)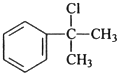 、
、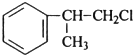 ;
;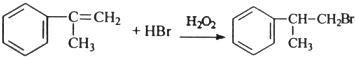 ;
; .
.