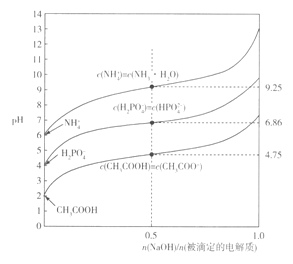
题目内容
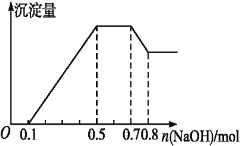
【题目】某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—
D. n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
【答案】C
【解析】
加锌产生无色无味气体说明锌与氢离子反应生成氢气,溶液中有大量氢离子,则没有碳酸根离子;加氢氧化钠溶液产生白色沉淀说明不含铁离子;由图像曲线变化可知溶液中含氢离子、铵根离子、镁离子、铝离子,加入氢氧化钠溶液,按照氢离子→镁离子和铝离子→铵根离子→氢氧化铝沉淀的顺序反应,沉淀量的变化是先在x轴上,然后逐渐增大,平行x轴,再减小,最后平行x轴,可以对照图象上的量求出各离子的量。
A、由于产生白色沉淀,则不存在铁离子。由图像可知溶液中含氢离子、铵根离子、镁离子、铝离子,A正确;
B、由图像可知溶解氢氧化铝消耗氢氧化钠的物质的量为0.8mol-0.7mol=0.1mol,由氢氧化铝沉淀溶解的方程式Al(OH)3+NaOH=NaAlO2+2H2O可知,氢氧化铝的物质的量为0.1mol,由铝原子个数守恒可知铝离子的物质的量为0.1mol,B正确;
C、加锌产生无色无味气体说明锌与氢离子反应生成氢气,溶液中有大量氢离子,则没有碳酸根离子,根据溶液中显电中性可知一定还有硫酸根离子,C错误;
D、由图中数据可知,中和氢离子的氢氧化钠的物质的量为0.1mol,溶液中氢离子的物质的量为0.1mol,溶解氢氧化铝沉淀的氢氧化钠的物质的量为0.1mol,氢氧化铝的物质的量为0.1mol,由铝原子个数守恒可知铝离子的物质的量为0.1mol,生成氢氧化镁和氢氧化铝沉淀消耗氢氧化钠的物质的量为0.5mol-0.1mol=0.4mol,生成氢氧化铝消耗氢氧化钠的物质的量为0.3mol,则生成氢氧化镁沉淀消耗氢氧化钠的物质的量为0.1mol,由方程式Mg2++2OH-=Mg(OH)2↓可知镁离子的物质的量为0.05mol,故氢离子、铝离子和镁离子的物质的量比为2:2:1,D正确。
答案选C。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】I.已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入__________________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
II. 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
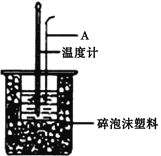
(1)仪器A的名称是__________________,烧杯间填满碎泡沫塑料的作用是__________________。
(2)加入NaOH溶液的正确操作是__________________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________________(结果保留一位小数)。
(4)实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量__________________(填“相等”“不相等”),若实验操作均正确,则所求中和热__________________(填“相等”“不相等”)。