题目内容
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E 同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为___________________。
(2)EAB2D4水溶液显酸性的原因是________________________________________。
(3)等浓度的EABD3和E2BD3混合溶液中,各离子的离子浓度由大到小的顺序为________________。
(4)A、B、D、E 四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2 溶液反应的离子方程式____________________________________________。
(5)常温下,测得X 和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2 (g ) 2CA3(g) ΔH=-92.4 kJ·mo1-1。反应达到平衡后,测得容器中各物质的物质的量分别为C2 0.5mol、A2 0.2mol、CA3 0.2 mol,此时容器体积为1.0 L。
①实验室制备CA3的的化学方程式____________________________。
②如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将__________移动(填“正向”、“逆向”或“不”)。
【答案】 ![]() 草酸氢根离子的水解程度小于其电离程度 (Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) Ba2++ HCO3-+ OH-= BaCO3↓+H2O 10-4: 1或1: 104 2NH4Cl+Ca(OH)2
草酸氢根离子的水解程度小于其电离程度 (Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) Ba2++ HCO3-+ OH-= BaCO3↓+H2O 10-4: 1或1: 104 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 逆向
CaCl2+2H2O+2NH3↑ 逆向
【解析】试题分析:A、B、C、D、E五种短周期元素,原子序数依次增大,A、E 同主族,A元素的原子半径最小,则A为氢元素;B元素原子的最外层电子数是内层电子数的2倍,则B为碳元素;C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,则C为氮元素,X为硝酸、Y为氯化铵;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源,则D为氧元素、E为钠元素。
(1)CO2的电子式为![]() 。
。
(2)H2C2O4是二元弱酸,HC2O4-既能电离又能水解,NaHC2O4水溶液显酸性的原因是:草酸氢根离子的水解程度小于其电离程度。
(3)等浓度的NaHCO3和Na2CO3混合溶液中,由于CO32-的水解程度大于HCO3-的水解程度、溶液显碱性,故各离子的离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
(4)H、C、O、Na 四种元素组成的某无机化合物,受热易分解,则该物质为碳酸氢钠。该化合物的溶液与足量的Ba(OH)2 溶液反应的离子方程式为Ba2++ HCO3-+ OH-= BaCO3↓+H2O。
(5)常温下,测得硝酸和氯化铵的水溶液的pH均为5,硝酸抑制水的电离而氯化铵水解促进水的电离,则硝酸中水电离的H+浓度等于c(OH-)=![]() ,氯化铵中水电离的H+浓度等于c(H+)=
,氯化铵中水电离的H+浓度等于c(H+)=![]() ,所以,两种水溶液中由水电离出的H+浓度之比是10-4: 1(或1: 104)。
,所以,两种水溶液中由水电离出的H+浓度之比是10-4: 1(或1: 104)。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:N2(g)+3H2 (g) 2NH3(g) ΔH=-92.4 kJ·mo1-1。反应达到平衡后,测得容器中各物质的物质的量分别为N2 0.5mol、H2 0.2mol、NH3 0.2 mol,气体的总物质的量为0.9mol,此时容器体积为1.0 L,平衡常数K=![]() 。
。
①实验室制备NH3的的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
②如果保持温度和压强不变,向上述平衡体系中加入0.18mol N2,若平衡不移动,则气体的总物质的量变为(0.9mol+0.18mol)=1.08mol,容器的体积变为![]() ,Qc=
,Qc=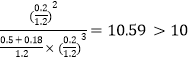 ,则平衡将逆向移动。
,则平衡将逆向移动。

【题目】某小组实验探究葡萄糖、二氧化硫分别与新制氢氧化铜的反应。
实验I新制Cu(OH)2与葡萄糖反应
(1)将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液。相关反应的离子方程式为___________。
(2)在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀。
①该实验现象说明_______________;
②该原理可用于检测糖尿病患者血液中的______含量。
实验II新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
(1)探究红色沉淀转变为紫红色的原因。
将实验I产生的红色沉淀过滤、洗涤,洗涤方法是_____。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图 |
|
|
操作及现象 | 红色固体很快转变为紫红色固体,溶液呈蓝色。 | 开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。 |
解释及结论 | ①该反应的离子方程式 _________________。 | ②开始时红色固体颜色变化缓慢的原因是_________。 ③所得无色溶液中主要阴离子为___________________。 |
(2)通过上述探究,写出新制氢氧化铜与过量SO2反应的总化学方程式______________。
反思:将表中SO2换为NO2是否能观察到相同现象?回答并解释:__________。



