题目内容
【题目】已知铁生锈的过程为:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·xH2O。又知草酸(H2C2O4)分解的化学方程式为H2C2O4![]() CO↑+CO2↑+H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和下图所示装置测定其中一种锈铁的组成。
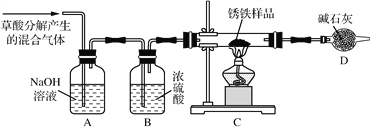
主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重8.4 g。
①装置A的作用是__________________,装置B的作用是__________________。
②根据以上数据能否测定出锈铁的组成?答:________(填“能”或“不能”)。
③该装置还存在的一个明显的缺陷是______________________。
(2)乙同学在甲同学装置的基础上,将装置D换成装浓硫酸的洗气瓶装置E(此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4 g,而装置E增重1.8 g,求:x 以及m(Fe)∶m(Fe2O3·xH2O) 的比值。(写出计算过程)____________
【答案】 除去混合气体中的CO2 除去混合气体中的H2O 不能 没有防止空气进入装置D中的设备,还缺少尾气处理装置 2,2∶7
【解析】(1)①根据草酸分解反应的化学方程式 H2C2O4![]() CO↑+CO2↑+H2O,可知混合气体中的CO2需要用NaOH溶液除去,确保CO的纯净,故装置A的作用是除去混合气体中的CO2;装置B是用浓硫酸干燥CO气体(或除去混合气体中的H2O蒸气);②已知数据有样品的质量12.6 g,通过反应后生成铁的质量8.4 g可求出铁原子的物质的量,装置D增重8.4 g是生成的CO2和样品中水的总质量,所以不能求出铁锈中氧原子的物质的量,因此不能推出铁锈的组成;③该装置还存在的一个明显的缺陷是装置D与空气相通,一方面不能吸收尾气,另一方面装置D中的碱石灰能吸收空气中的CO2和H2O蒸气,导致测定生成的CO2质量不准;
CO↑+CO2↑+H2O,可知混合气体中的CO2需要用NaOH溶液除去,确保CO的纯净,故装置A的作用是除去混合气体中的CO2;装置B是用浓硫酸干燥CO气体(或除去混合气体中的H2O蒸气);②已知数据有样品的质量12.6 g,通过反应后生成铁的质量8.4 g可求出铁原子的物质的量,装置D增重8.4 g是生成的CO2和样品中水的总质量,所以不能求出铁锈中氧原子的物质的量,因此不能推出铁锈的组成;③该装置还存在的一个明显的缺陷是装置D与空气相通,一方面不能吸收尾气,另一方面装置D中的碱石灰能吸收空气中的CO2和H2O蒸气,导致测定生成的CO2质量不准;
(2)根据乙同学的实验,反应后的固体为铁,质量为8.4g,则n(Fe)=0.15mol,浓硫酸只吸收了铁锈样品中的水,质量为1.8g,即n(H2O)=0.1mol,所以样品中n(O)= ![]() = 0.15mol,即得n(Fe2O3)=0.05 mol,则样品中铁单质的n(Fe)= 0.15mol—0.05 mol×2=0.05mol,所以n(Fe2O3) ∶n(H2O) =0.05 mol∶0.1mol =1∶2,即x=2;m(Fe)∶ m(Fe2O3·xH2O) = (0.05mol×56g/mol) ∶(0.05mol×160g/mol+1.8g) =2∶7。
= 0.15mol,即得n(Fe2O3)=0.05 mol,则样品中铁单质的n(Fe)= 0.15mol—0.05 mol×2=0.05mol,所以n(Fe2O3) ∶n(H2O) =0.05 mol∶0.1mol =1∶2,即x=2;m(Fe)∶ m(Fe2O3·xH2O) = (0.05mol×56g/mol) ∶(0.05mol×160g/mol+1.8g) =2∶7。



