题目内容
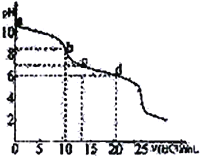
【题目】常温下,用等浓度的NaOH溶液分別滴定相同体积的NH4Cl、KH2PO4及CH3COOH溶液,滴定曲线如下图所示:
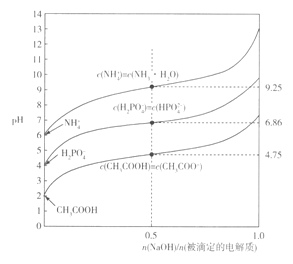
下列说法正确的是
A. NH3·H2O===NH4++OH-的lg K =-9.25
B. 0.1mol/LKH2PO4溶液中:c( HPO42- )<c(H3PO4)
C. CH3COOH+HPO42-=CH3COO-+H2PO4-的lg K = -11.61
D. 在滴定过程中,当溶液pH相同时,消耗NaOH 的物质的量:CH3COOH>KH2PO4> NH4Cl
【答案】D
【解析】A.由图象可知,当加入的氢氧化钠与被滴定NH4Cl物质的量之比为1:2时,n(NH4+)=n(NH3![]() H2O),NH3·H2O
H2O),NH3·H2O![]() NH4++OH-的平衡常数K=c(NH4+)c(OH-)/c(NH3.H2O)=c(OH-)=10-14/10-9.25=10-4.75,lgK=-4.75,故A错;B.由于KH2PO4溶液的pH为4,说明H2PO4-电离大于水解,所以c(HPO42-)>c(H3PO4),故B错;C.CH3COOH+HPO42-
NH4++OH-的平衡常数K=c(NH4+)c(OH-)/c(NH3.H2O)=c(OH-)=10-14/10-9.25=10-4.75,lgK=-4.75,故A错;B.由于KH2PO4溶液的pH为4,说明H2PO4-电离大于水解,所以c(HPO42-)>c(H3PO4),故B错;C.CH3COOH+HPO42-![]() CH3COO-+H2PO4-,平衡常数K=
CH3COO-+H2PO4-,平衡常数K=![]() =
=![]() ,用和求K(NH3
,用和求K(NH3![]() H2O)同样的方法可计算出K(CH3COOH)=10-4.75,K(H2PO4-)=10-6.86,则
H2O)同样的方法可计算出K(CH3COOH)=10-4.75,K(H2PO4-)=10-6.86,则![]() =10-4.75/10-6.86=102.11,lgK=2.11,故C错误;D项,从图像可知,在滴定过程中,当溶液pH相同时,消耗NaOH的物质的量:CH3COOH>KH2PO4>NH4Cl,故D正确;综合以上分析,本题正确答案为D。
=10-4.75/10-6.86=102.11,lgK=2.11,故C错误;D项,从图像可知,在滴定过程中,当溶液pH相同时,消耗NaOH的物质的量:CH3COOH>KH2PO4>NH4Cl,故D正确;综合以上分析,本题正确答案为D。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目