题目内容
【题目】I.已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入__________________。
A.硫酸钾 B.硫酸锰 C.氯化钾 D.水
II. 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
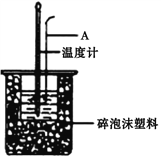
(1)仪器A的名称是__________________,烧杯间填满碎泡沫塑料的作用是__________________。
(2)加入NaOH溶液的正确操作是__________________ (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=__________________(结果保留一位小数)。
(4)实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量__________________(填“相等”“不相等”),若实验操作均正确,则所求中和热__________________(填“相等”“不相等”)。
【答案】 Mn2+的催化作用(或催化剂) B 环形玻璃搅拌棒 减少热量损失 B -51.8 kJ/mol 不相等 相等
【解析】I. (1).对化学反应速率影响最大的是催化剂,KMnO4与H2C2O4反应生成MnSO4,Mn2+有催化作用,则还可能是催化剂的影响,故答案为:Mn2+的催化作用(或催化剂);
(2).根据上述分析可知,对化学反应速率产生影响的还可能是Mn2+,若要实验证明这种猜想,除酸性高锰酸钾溶液、草酸溶液外,在反应开始时还应加入含有锰离子的物质,故答案选B;
II. (1).仪器A的名称是环形玻璃搅拌棒,在烧杯间填满碎泡沫塑料可以减少热量的损失,故答案为:环形玻璃搅拌棒;减少热量损失;
(2).为了减少热量的损失,加入NaOH溶液时,应一次迅速加入,故答案选B;
(3).三次实验测得(t2-t1)的值分别为:3.15℃、3.1℃、3.05℃,最终温度差△T的平均值为(3.15+3.1+3.05) ℃÷3=3.1℃,40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液混合生成0.02mol水,所得混合液的质量为80mL×1g/mL=80g,c=4.18J/(g·℃),代入公式Q=c×m×△T得生成0.02mol水时放出的热量Q=4.18J/(g·℃)×80g×3.1℃=1036.64J=1.03664kJ,则生成1mol水时放出的热量为1.03664kJ×![]() =51.8kJ,所以该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
=51.8kJ,所以该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
(4).实验中若改用50 mL 0.50 mol/L的盐酸与40 mL 0.55 mol/L的氢氧化钠溶液进行反应,生成水的量增多,则反应放出的热量也增多,因中和热均为强碱和强酸的稀溶液反应生成1mol水时放出的热量,与酸碱的用量无关,则测定的中和热相等,故答案为:不相等;相等;

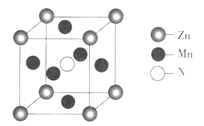
【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大
A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
C | 与B同主族 |
D | 前四周期中金属性最强的元素 |
E | 前四周期中原子核外孤电子数最多 |
(1)C元素位于第__________________周期__________________族,B元素的核外电子排布式为__________________,E元素的价电子排布图为__________________。
(2)B、C两元素的电负性大小关系为:__________________(用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:________________(用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有__________________。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是__________________。
(5)D2B2的电子式为__________________,与CO2反应生成B的单质的化学方程式为:__________________。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:__________________
【题目】某小组实验探究葡萄糖、二氧化硫分别与新制氢氧化铜的反应。
实验I新制Cu(OH)2与葡萄糖反应
(1)将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液。相关反应的离子方程式为___________。
(2)在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀。
①该实验现象说明_______________;
②该原理可用于检测糖尿病患者血液中的______含量。
实验II新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
(1)探究红色沉淀转变为紫红色的原因。
将实验I产生的红色沉淀过滤、洗涤,洗涤方法是_____。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图 |
|
|
操作及现象 | 红色固体很快转变为紫红色固体,溶液呈蓝色。 | 开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。 |
解释及结论 | ①该反应的离子方程式 _________________。 | ②开始时红色固体颜色变化缓慢的原因是_________。 ③所得无色溶液中主要阴离子为___________________。 |
(2)通过上述探究,写出新制氢氧化铜与过量SO2反应的总化学方程式______________。
反思:将表中SO2换为NO2是否能观察到相同现象?回答并解释:__________。