题目内容
下列分子中,所有原子都满足最外层8电子稳定结构的是( )
| A.光气(COCl2) | B.六氟化硫(SF6) |
| C.三氟化硼(BF3) | D.五氯化磷(PCl5) |
A
解析试题分析:只要分子中元素化合价的绝对值与该元素原子的最外层电子数之和满足8,则该元素的原子就能满足8电子的稳定结构。据此可知,选项B中的S元素、C中的B元素、D中的P元素均不能满足8 电子稳定结构,答案选A。
考点:考查元素原子8电子稳定结构的判断
点评:该题是基础性试题的考查,难度不大。该题的关键是明确8电子稳定结构的含义以及判断依据,然后准确判断出元素的化合价即可。有利于培养学生的逻辑思维能力和应试能力。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
X、Y、Z、W是原子序数依次递增的4种短周期元素。其中X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z原子的L层电子数比K层与M层电子数之和多5个,W在同周期元素中非金属性最强。下列说法正确的是( )
| A.X、Y、Z 3种元素组成的化合物中阴、阳离子所含电子数不等 |
| B.X与Z为同主族元素,它们的单质与W单质反应均失去电子 |
| C.Y、Z、W 3种元素组成的某种化合物可用于消毒 |
| D.Y与Z的单质在常温下反应生成Z2Y2 |
原子结构模型的演变图中,①为道尔顿实心球式原子模型、②为卢瑟福带核的原子模型、③为汤姆生葡萄干面包式原子模型、④为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是( )
① ② ③ ④
| A.①③②④ | B.①②③④ |
| C.①④③② | D.①③④② |
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是
| A.热稳定性:H2Y<HZ | B.原子半径:W>X>Z>Y |
| C.离子半径:W2+>Y2- | D.碱性:XOH<W(OH)2 |
下列叙述中,正确的是
| A.同周期元素中,ⅦA族元素的原子半径最大 |
| B.ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C.室温时,0族元素的单质都是气体 |
| D.元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是副族元素 |
下列各选项中两种粒子所含电子数不相等的是
| A.羟甲基(-CH2OH)和甲氧基(CH3O-) |
| B.羟基(-OH)和氢氧根(OH-) |
| C.硝基(-NO2)和二氧化氮(NO2) |
| D.亚硝酸(HNO2)和亚硝酸根(NO2—) |
科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差为
| A.47 | B.57 |
| C.61 | D.175 |
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | | | |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式__________________________________。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:
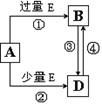
①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。
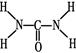 ,则尿素分子中C和N原子的杂化方式分别是、。
,则尿素分子中C和N原子的杂化方式分别是、。