题目内容
科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差为
| A.47 | B.57 |
| C.61 | D.175 |
B
解析试题分析:因为中子数+质子数=质量数,核外电子数=质子数,所以该核素的中子数与核外电子数之差为293-118-118=57,答案选B。
考点:考查原子组成以及组成原子的几种微粒之间的计算
点评:该题是高考中的常见题型,试题以新科技、新发现为载体,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。

练习册系列答案
相关题目
下列关于18O的说法中正确的是
| A.该原子核内有18个质子 | B.该原子核内有8个中子 |
| C.该原子核外有8个电子 | D.该原子的质量数为26 |
放射性同位素铀 的原子核内的中子数是
的原子核内的中子数是
| A.143 | B.92 | C.51 | D.235 |
下列分子中,所有原子都满足最外层8电子稳定结构的是( )
| A.光气(COCl2) | B.六氟化硫(SF6) |
| C.三氟化硼(BF3) | D.五氯化磷(PCl5) |
根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A.由左至右第8、9、10三列元素中没有非金属元素 |
| B.第三、四、五、六周期元素的数目分别是18、18、32、32 |
| C.L电子层为奇数的所有元素都是非金属 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
超铀元素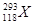 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子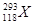 的中子数与核外电子数之差为
的中子数与核外电子数之差为
| A.0 | B.118 |
| C.57 | D.175 |
(9分)下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
| a | | | |||||||||||||||
| | | | | f | | h | i | | |||||||||
| | b | | e | | | | j | | |||||||||
| c | | | | | | | | d | | | | | g | | | k | |
| | | | | | | | | | | | | | | | | l | |
(2)请写出上述元素k的核外电子排布式 ;
(3)b、e、j三种元素的电负性由大到小的顺序 (写元素符号);此三种元素的第一电离能由大到小的顺序 (写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水化物与a、c、h三种元素形成的化合物反应的离子方程式 ;
(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出k、l的互化物的电子式 ,它是由 键形成的 化合物(填“离子”或“共价”)。