题目内容
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是
| A.热稳定性:H2Y<HZ | B.原子半径:W>X>Z>Y |
| C.离子半径:W2+>Y2- | D.碱性:XOH<W(OH)2 |
A
解析试题分析:aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,则一定满足关系式a-2=b-1=c+2=d+1。其中W和X属于金属,位于同一周期,且W在X的右侧。Y和Z是非金属,位于同一周期,且位于W和X的上一周期,其中Z位于Y的右侧。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,碱性逐渐减弱,氢化物的稳定性逐渐减弱,所以选项A正确。原子半径:X>W>Y>Z,B不正确;核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,离子半径:W2+>Y2-,则选项C不正确。碱性:XOH>W(OH)2,D不正确,答案选A。
考点:考查核外电子排布以及元素周期律的应用
点评:该题是中等难度的试题,也高考中的常见题型。试题贴近高考,侧重对学生能力的培养。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
| A.原子半径:Z>Y>X |
| B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 |
| C.Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂 |
| D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2 |
16O中的16表示的含义是( )
| A.氧元素的相对原子质量 |
| B.氧元素的一种同位素的近似相对原子质量 |
| C.氧元素的近似相对原子质量 |
| D.氧元素的一种同位素的质量数 |
同一周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性是: HXO4 >H2YO4 >H3ZO4,则下列判断错误的是
| A.原子半径:X > Y > Z | B.气态氢化物的稳定性:HX > H2Y > ZH3 |
| C.非金属性:X > Y > Z | D.阴离子的还原性:Z3- > Y2- > X- |
放射性同位素铀 的原子核内的中子数是
的原子核内的中子数是
| A.143 | B.92 | C.51 | D.235 |
铋(Bi)在医药方面有重要应用。 下列关于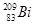 和
和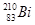 的说法正确的是
的说法正确的是
A.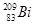 和 和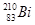 都含有83个中子 都含有83个中子 |
B.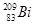 和 和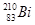 互为同位素 互为同位素 |
C.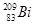 和 和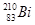 的核外电子数不同 的核外电子数不同 |
D.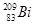 和 和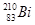 分别含有126和127个质子 分别含有126和127个质子 |
下列分子中,所有原子都满足最外层8电子稳定结构的是( )
| A.光气(COCl2) | B.六氟化硫(SF6) |
| C.三氟化硼(BF3) | D.五氯化磷(PCl5) |
超铀元素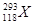 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子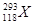 的中子数与核外电子数之差为
的中子数与核外电子数之差为
| A.0 | B.118 |
| C.57 | D.175 |
(14分)下面是元素周期表的一部分。据A至H在周期表中位置,请回答下列问题:
| A | | | |||||||||||||||
| | | | | | E | | G | | |||||||||
| B | C | D | | | F | H | | ||||||||||
| | | | | | | | | | | | | | | | | | |
以下请用元素符号或化学式填空:
(2)原子半径最大的是 , A分别与E、F、G、H形成的化合物中,最稳定的化合物是 。
(3)最高价氧化物是两性氧化物的是 ,最高价氧化物对应的水化物碱性最强的是 ,最高价氧化物对应水化物的酸性最强的是 。
(4)C与H形成的化合物中含有 (填“共价”或“离子”)键;用电子式表示C、H形成化合物的过程 。