题目内容
19.常温下,测得某溶液NaHX的pH>7,该溶液中有关浓度关系式正确的是( )| A. | c(Na+)>c(H+)+c(X2-) | B. | c(Na+)=c(H2X)+c(HX-)+c(X2-) | ||
| C. | c(X2-)>c(H2X) | D. | c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-) |
分析 常温下,测得某溶液NaHX的pH>7,说明溶液中HX-的电离程度小于其水解程度,则:c(H+)<c(OH-)、c(X2-)<c(H2X);溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-)、物料守恒:c(Na+)=c(H2X)+c(HX-)+c(X2-),据此对各选项进行判断.
解答 解:常温下,测得某溶液NaHX的pH>7,说明溶液中HX-的电离程度小于其水解程度,则:c(H+)<c(OH-)、c(X2-)<c(H2X),
A.根据物料守恒可得:c(Na+)=c(H2X)+c(HX-)+c(X2-),由于c(HX-)>c(H+),则c(Na+)>c(H+)+c(X2-),故A正确;
B.根据溶液中的电荷守恒可得:c(Na+)=c(H2X)+c(HX-)+c(X2-),故B正确;
C.根据分析可知,c(X2-)<c(H2X),故C错误;
D.根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),故D错误;
故选AB.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力,注意掌握判断离子浓度 大小常用方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.化学与生产、生活密切相关,下列有关说法正确的是( )
| A. | 葡萄糖注射液能产生丁达尔效应 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 | |
| D. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 |
10.25℃时,K甲(BaSO4)=1×10-10,K甲(BaCO3)=2.6×10-8,该温度下,下列说法不正确的是( )
| A. | 相同浓度的Na2SO4和Na2CO3的混合溶液中添加BaCl2溶液,BaSO4先析出 | |
| B. | 向BaCO3的悬浊液中加入少量的新制氯水,r(Ba2+)增大 | |
| C. | BaSO4和BaCO3共存的悬浊液中,c(SO42-)/c(CO32-)=1/26 | |
| D. | 向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3 |
7.下列说法或表达正确的是( )
| A. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| B. | 石油是混合物,其分馏产品汽油也是混合物 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
14.对于钠的卤化物(NaX)和硅的卤化物分子(SiX4),下列叙述正确的是( )
| A. | SiX4呈空间网状结构,硬度大 | |
| B. | NaX的熔点一般高于SiX4 | |
| C. | NaX易水解 | |
| D. | SiX4由原子构成,熔化时破坏共价键 |
8.下列各组离子在溶液中能大量共存的是( )
| A. | K+、OH-、Na+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
9.已知:某温度时,KW=1.0×10-12.在该温度下,测得0.1mol•L-1Na2A溶液pH=6,则下列说法正确的是( )
| A. | H2A在水溶液中的电离方程式为:H2A=H++HA-,HA-?H++A2- | |
| B. | 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(A2-) | |
| C. | 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 | |
| D. | 0.0l mol•L-l的NaHA溶液pH>2 |
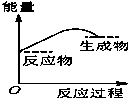
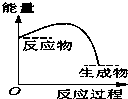
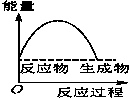
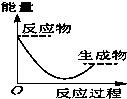
 将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )
将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )