题目内容
12.根据下列所表示的氧化还原反应设计一个能持续产生电流的原电池装置.Fe(s)+2Fe3+(aq)=3Fe2+(aq)
(1)画出此原电池的装置简图(2)写出两个电极上的电极反应.
分析 由方程式可知,反应中只有Fe元素化合价变化,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,Fe3+被还原生成Fe2+,则电解质为FeCl3,以此解答该题.
解答 解:(1)由方程式可知,反应中只有Fe元素化合价变化,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,Fe3+被还原生成Fe2+,则电解质为FeCl3,则此原电池的装置图为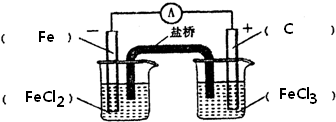 ,
,
故答案为: ;
;
(2)负极为Fe,发生氧化反应生成Fe2+,电极反应式为Fe-2e-=Fe2+,正极为活泼性比铁弱的金属或非金属,可为碳棒,发生还原反应,Fe3+被还原生成Fe2+,电极方程式为2Fe3++2e-=2Fe2+,
答:负极:Fe-2e-=Fe2+;正极:2Fe3++2e-=2Fe2+.
点评 本题考查原电池的设计及原电池的工作原理,题目难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
2.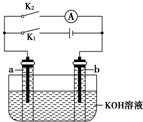 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1一段时间,溶液的pH变大 | |
| B. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| C. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
3.现代冶炼金属锰的一种工艺流程如下图所示:
下表为t℃时,有关物质的pKp(注:pKp=-1gKp)
①软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4=12MnSO4+6CO2↑+18H2O该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高温度或将软锰矿研细等
②滤液1的pH>(填“>”“<”或“═”)MnSO4浸出液的pH.
③加入MnF2的目的除去Ca2+(填“Ca2+”、“Fe3+”、或“Cu2+”)

下表为t℃时,有关物质的pKp(注:pKp=-1gKp)
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKp | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
②滤液1的pH>(填“>”“<”或“═”)MnSO4浸出液的pH.
③加入MnF2的目的除去Ca2+(填“Ca2+”、“Fe3+”、或“Cu2+”)
 根据实验装置和下述操作,回答下列有关问题:
根据实验装置和下述操作,回答下列有关问题: