题目内容
5.在试管里放入一块铜片,注入一定体积的浓硫酸,给试管加热,使之反应.(1)若铜片还有剩余,硫酸没有消耗完毕(填“已”或“没有”).其理由是因随反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑的进行,硫酸变稀,而稀H2SO4不与Cu反应,故H2SO4不会耗完.
(2)欲观察生成的CuSO4溶液的颜色,应采取的操作是加少量蒸馏水稀释.
(3)用一定量的废铜屑制取胆矾,有两种方法:一种是取Cu与浓H2SO4直接反应;二是先将铜在空气中加热使之生成CuO,再与稀H2SO4反应,其中第二种种方法好,理由是既节省H2SO4又防止产生SO2造成污染.
分析 (1)随着反应的进行,浓硫酸浓度逐渐降低,稀硫酸与铜不反应;
(2)欲观察生成的CuSO4溶液的颜色,可以加水使溶液变稀;
(3)浓硫酸与铜反应生成二氧化硫气体,可污染环境,且消耗硫酸较多.
解答 解:(1)浓硫酸与铜发生反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,随着反应的进行,浓硫酸浓度逐渐降低,稀硫酸与铜不反应,则硫酸不能消耗完毕,
故答案为:没有;因随反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑的进行,硫酸变稀,而稀H2SO4不与Cu反应,故H2SO4不会耗完;
(2)欲观察生成的CuSO4溶液的颜色,可以加水使溶液变稀,可以加水使溶液变稀,故答案为:加少量蒸馏水稀释;
(3)浓硫酸与铜反应生成二氧化硫气体,可污染环境,且消耗硫酸较多,则选择第二种方法好,故答案为:第二种;既节省H2SO4又防止产生SO2造成污染.
点评 本题考查浓硫酸的性质,侧重于化学与生产的考查,有利于培养学生的良好科学素养和学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
11.如图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液.下列说法不正确的是( )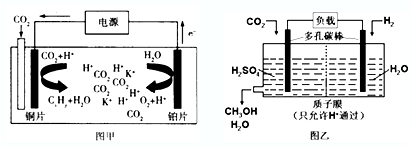

| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+6e-+6H+═CH3OH+H2O |
20.下列物质的分类采用树状分类法的是( )
| A. | 铁是单质,又是导体 | |
| B. | 氧化物可分为金属氧化物和非金属氧化物 | |
| C. | 氯化钠是钠的化合物,又是氯化物 | |
| D. | 氢氧化钙是纯净物、化合物,又是碱 |
10.下列说法中,正确的是( )
| A. | 浓硫酸与稀硫酸具有强氧化性 | |
| B. | 某强酸性溶液中含有较多的SO32-、S2- | |
| C. | SO2、H2SO3、H2S都具有还原性 | |
| D. | 加BaCl2溶液生成白色沉淀,原溶液中一定含有SO42- |
17.除去铝表面的铜镀层可选用的试剂是( )
| A. | 浓硝酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 浓硫酸 |