题目内容
2.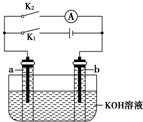 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1一段时间,溶液的pH变大 | |
| B. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| C. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
分析 A、断开K2,闭合K1时,相当于电解装置,电解氢氧化钾溶液的实质为电解水;
B、断开K1,闭合K2时,形成氢氧燃料电池;
C、断开K2,闭合K1时,形成电解池,阳极发生失电子的氧化反应;
D、原电池中,电解质里的阴离子移向电池的负极.
解答 解:A、断开K2,闭合K1时,相当于电解装置,相当于电解氢氧化钾,实质是电解水,所以氢氧化钾的浓度增大,pH要变大,故A正确;
B、断开K1,闭合K2时,形成氢氧燃料电池,在a极附近有大量的氧气,在b极附近有大量的氢气,此时b极是负极,发生失电子的氧化反应,在碱性电解质下,电极反应为:2OH-+H2-2e-═2H2O,故B错误;
C、断开K2,闭合K1时,形成电解池,a极是阳极,氢氧根离子发生失电子的氧化反应,即4OH--4e-═O2↑+2H2O,故C正确;
D、断开K1,闭合K2时,形成氢氧燃料电池,a极是充满氧气的正极,b极是充满氢气的负极,电解质里的阴离子移向电池的负极移动,即OH-向b极移动,故D正确.
故选B.
点评 本题考查学生原电池和电解质的工作原理,是一道物理电路和化学电池联系的一道综合题目,难度较大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
12.有关溴乙烷的下列叙述中,正确的是( )
| A. | 溴乙烷不溶于水,其密度比水的小 | |
| B. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| C. | 溴乙烷与NaOH的醇溶液混合共热可生成乙烯 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
13.含有下列各组离子的溶液中,通入NH3后仍能大量共存的是( )
| A. | H+,Cu2+,Fe3+、SO4 2- | B. | Ba2+,Na+,Al3+、Cl- | ||
| C. | K+、Ag+ NH4+,NO3- | D. | Na+、K+、Br-、OH- |
10.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | Y单质在一定条件下可以与氧化铁发生置换反应 | |
| D. | 室温下,0.1 mol/L w的气态氢化物的水溶液的氢离子浓度小于0.1 mol/L |
7.下列说法正确的是( )
| A. | 大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | Na2O2、NH4C1、MgCl2均属于含有共价键的离子化合物 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 玻璃、水泥和光导纤维的主要成分都是硅酸盐 |
11.如图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液.下列说法不正确的是( )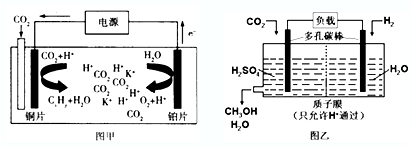

| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+6e-+6H+═CH3OH+H2O |
 金属铝、铁、铜及其化合物与生产、科研关系密切.
金属铝、铁、铜及其化合物与生产、科研关系密切.