题目内容
2.在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-六种离子中的三种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )| A. | K+、OH-、CO32 | B. | CO32-、OH-、Cl- | C. | K+、H+、Cl- | D. | Cu2+、H+、Cl- |
分析 甲溶液呈蓝色,应含有Cu2+,则与Cu2+反应的离子应存在于乙中,结合溶液的电中性原则及离子共存的条件进行解答.
解答 解:甲溶液呈蓝色,应含有Cu2+,因CO32-、OH-可与反应生成沉淀,则只能存在于乙中,乙中含有CO32-、OH-,则一定不存在H+,阳离子只能为K+,
则乙中含有的离子为:CO32-、OH-、K+,甲中含有的离子为:Cu2+、H+、Cl-,
故选A.
点评 本题考查离子共存问题,为高考常见题型,题目难度中等,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意把握离子之间发生复分解反应的特点.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
12.关于强、弱电解质的叙述不正确的是( )
| A. | 强电解质在溶液中完全电离,其水溶液中不存在分子 | |
| B. | 同一弱电解质溶液,温度不同时,导电能力不同 | |
| C. | 强电解质溶液导电能力不一定比弱电解质溶液的导电能力强 | |
| D. | 强电解质在液态时不一定会导电,但在固态时一定不导电 |
13.某固体纯净物X受热分解:X $\frac{\underline{\;\;△\;\;}}{\;}$A↑+B↑+2CuO,气体产物对氢气的相对密度为15.5,则X的相对分子质量为( )
| A. | 31 | B. | 62 | C. | 222 | D. | 142 |
17.下列反应完成后没有沉淀的是( )
| A. | BaCl2溶液与Na2CO3溶液加足量稀盐酸 | |
| B. | Ba(OH)2溶液与KNO3溶液加足量稀H2SO4 | |
| C. | AgNO3溶液与Na2CO3溶液加足量稀HCl | |
| D. | Fe与足量CuSO4溶液反应后加足量稀H2SO4 |
11.二氧化硫的催化氧化是放热反应.下列关于接触法制硫酸的叙述中正确的是( )
| A. | 为防止催化剂中毒,炉气在进入接触室之前需要净化 | |
| B. | 为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ | |
| C. | 为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收 | |
| D. | 为提高SO3的吸收效率,用稀硫酸代替水吸收SO3 |
12.下列操作不属于混合物分离的是( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 搅拌 |

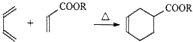
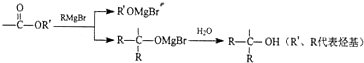
 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$
 、
、 .
. .
.