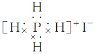题目内容
【题目】(1)下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
①表示核素的符号共________种。
②质量数相等,但不能互称同位素的是________和________。
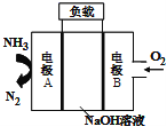
(2)为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答:
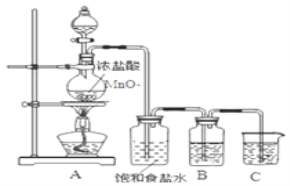
①装置B中盛放的试剂是____________(填选项),实验现象为____________。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
②能证明氯元素比硫元素非金属性强的依据为____________。(填序号)
A.盐酸为强酸,氢硫酸为弱酸 B.次氯酸的氧化性比稀硫酸强
C.S2-比Cl-还原性强 D.HCl比H2S稳定
(3)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____________。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____________。
【答案】6 ![]()
![]() A 产生淡黄色沉淀 CD 0.16mol·L-1·min-1 61.5%
A 产生淡黄色沉淀 CD 0.16mol·L-1·min-1 61.5%
【解析】
(1)①表示核素的符号有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,共6种。故答案为:6;
,共6种。故答案为:6;
②质量数相等,但不能互称同位素的是![]() 和
和![]() 。故答案为:
。故答案为:![]() ;
;![]() ;
;
(2)①验证氯元素的非金属性比硫元素的非金属性强,可用置换法,用氯气将硫从硫化物中置换出来,装置B中盛放的试剂是Na2S溶液,故选A,化学方程式为Na2S+Cl2=2NaCl+S↓,离子方程式为S2-+Cl2=2Cl-+S↓,实验现象为产生淡黄色沉淀。
故答案为:A;产生淡黄色沉淀;
②可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HClO4的酸性比H2SO4的酸性强;氯气的氧化性强于单质S的氧化性,或是S2-比Cl-易被氧化;还可以根据单质将变价金属氧化到的价态高低来确定单质的氧化性,进而确定元素得非金属性强弱;
故答案为:CD;
(3)

v(NO2)=![]() =0.16mol·L-1·min-1;
=0.16mol·L-1·min-1;
所以混合气体的物质的量为3.2mol+1.6mol+0.4mol=5.2 mol,混合气体中N2O5的物质的量为(4-0.8)mol=3.2mol,N2O5占混合气体的物质的量分数为![]() ×100%=61.5%;
×100%=61.5%;
故答案为:0.16mol·L-1·min-1;61.5%。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】在A~I的元素中选择符合题意的元素,按要求回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)只有负价而无正价的是______(填元素名称);
(2)最高价氧化物的水化物酸性最强的是____(填化学式);
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物的结构式 _____;
(4)在B、C、D、J、 E、F、G、H中,原子半径最大的是____(填原子符号);
(5)画出上述元素中金属性最强的元素的原子结构示意图______;
(6)C单质与氢氧化钠溶液反应的离子方程式________________________;
(7)用电子式表示E单质的形成过程_______________________
(8)写出冶炼B单质的化学方程式____________________;
(9)D的最简单氢化物的燃烧热为890.3 kJ/mol,写出D的最简单氢化物燃烧热的热化学方程式_____;
(10)写出NaHSO4熔融时电离方程式______________________。
【题目】下表列出了①~⑩10种元素在周期表中的位置。
族 周期 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,金属性最强的是(填元素符号,下同)________,③④⑤三种元素的原子半径由大到小的顺序是____________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式)
(3)元素⑥的氢化物的电子式为____________,该氢化物与元素⑥的最高价氧化物对应的水化物反应的化学方程式为____________。
(4)比较⑥和⑦氢化物的稳定性由强到弱的顺序是____________(填化学式)。