题目内容
【题目】同主族元素形成的同类型的化合物,往往其结构和性质相似。下列对化合物碘化磷(PH4I)的叙述错误的是( )
A.它是一种离子化合物
B.这种化合物加热时,可能产生有色气体
C.这种化合物的电子式为: 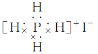
D.这种化合物可以和烧碱发生反应
【答案】C
【解析】
同主族元素所形成的同一类型的化合物,其结构和性质往往相似,则PH4I与NH4Cl性质相似,根据NH4Cl的性质判断。
A.PH4I与NH4Cl性质相似,都属于离子化合物,故A正确;
B.因NH4Cl能分解:NH4Cl![]() NH3+HCl,所以PH4I
NH3+HCl,所以PH4I![]() PH3+HI,但HI不稳定,还可以继续分解:2HIH2+I2,I2为紫色,故B正确;
PH3+HI,但HI不稳定,还可以继续分解:2HIH2+I2,I2为紫色,故B正确;
C.碘化磷的电子式与氯化铵的相似,为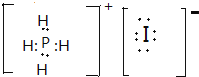 ,故C错误;
,故C错误;
D.由NH4Cl的性质判断,该化合物可与强碱发生反应生成PH3,故D正确。
答案选C。

练习册系列答案
相关题目
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |