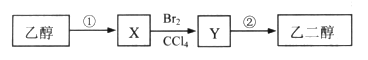
题目内容
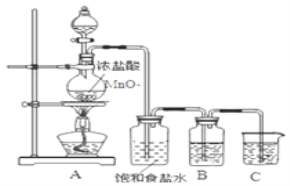
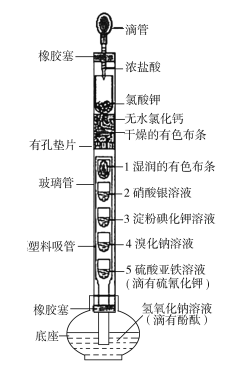
【题目】某化学实验创新小组设计了如图所示的检验Cl2某些性质的一体化装置。下列有关描述不正确的是
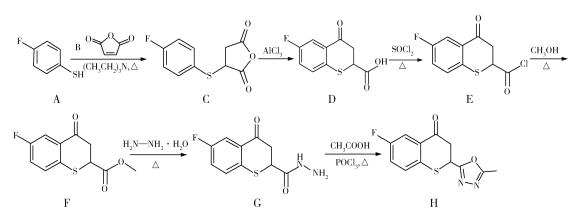
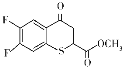
A.浓盐酸滴到氯酸钾固体上反应的离子方程式为5Cl+![]() +6H+===3Cl2↑+3H2O
+6H+===3Cl2↑+3H2O
B.无水氯化钙的作用是干燥Cl2,且干燥有色布条不褪色,湿润的有色布条褪色
C.2处溶液出现白色沉淀,3处溶液变蓝,4处溶液变为橙色,三处现象均能说明了Cl2具有氧化性
D.5处溶液变为血红色,底座中溶液红色消失,氢氧化钠溶液的作用为吸收剩余的Cl2以防止污染
【答案】C
【解析】
浓盐酸滴到氯酸钾固体上的作用是为了制备Cl2,根据含同种元素物质间发生氧化还原反应时,化合价只靠近不交叉,配平后可得反应的离子方程式:5Cl+![]() +6H+===3Cl2↑+3H2O,A正确;为了检验Cl2有无漂白性,应该先把Cl2干燥,所以,无水氯化钙的作用是干燥Cl2,然后会出现干燥有色布条不褪色而湿润有色布条褪色的现象,B正确;Cl2与3处碘化钾置换出单质碘,遇淀粉变蓝,与4处溴化钠置换出单质溴,使溶液变橙色,均说明了Cl2具有氧化性,Cl2与水反应生成HCl和HClO,HCl与硝酸银产生白色沉淀,无法说明Cl2具有氧化性,C错误;Cl2与5处硫酸亚铁生成Fe3+,Fe3+与SCN生成血红色配合物,氢氧化钠溶液可以吸收剩余的Cl2,防止污染空气,D正确。
+6H+===3Cl2↑+3H2O,A正确;为了检验Cl2有无漂白性,应该先把Cl2干燥,所以,无水氯化钙的作用是干燥Cl2,然后会出现干燥有色布条不褪色而湿润有色布条褪色的现象,B正确;Cl2与3处碘化钾置换出单质碘,遇淀粉变蓝,与4处溴化钠置换出单质溴,使溶液变橙色,均说明了Cl2具有氧化性,Cl2与水反应生成HCl和HClO,HCl与硝酸银产生白色沉淀,无法说明Cl2具有氧化性,C错误;Cl2与5处硫酸亚铁生成Fe3+,Fe3+与SCN生成血红色配合物,氢氧化钠溶液可以吸收剩余的Cl2,防止污染空气,D正确。

 名校课堂系列答案
名校课堂系列答案【题目】印刷电路板在电子行业中应用广泛,其中的铜质线路是通过化学试剂刻蚀覆盖在有机绝缘材料上的铜板形成的。从废弃的印刷电路板上可以回收铜及其化合物。甲、乙、丙三组同学分别采用了不同的回收方案如下(部分产物略去):
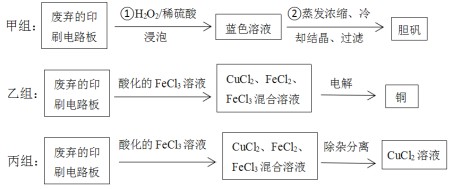
(1)甲组步骤①中反应的离子方程式为:______。
(2)甲组同学进行实验时,发现H2O2已变质不能使用,他们需要在不使用H2O2的前提下实现反应Cu+H2SO4=CuSO4+H2↑。在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”,不能实现的装置中不要填写)。
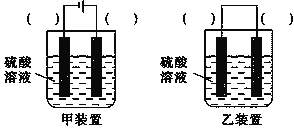
________
(3)乙组同学使用的FeCl3溶液需要酸化的原因是:________。
(4)图为乙组电解时的装置图。其中铜电极应该与电源的_____(填“正极”或“负极”)相连。当观察到阴极有少量气泡产生时,即停止电解,此时要回收的铜已全部析出。则阴极发生的电极反应为(按反应发生的先后顺序书写):_____、___、___。
(5)乙组同学用1L 0.2mol/L的FeCl3溶液溶解铜,电解时,阴极产生无色气体0.56L(标准状况下)时停止电解,此时阳极产生的气体在标准状况下的体积共_____L。
(6)丙组同学利用FeCl3腐蚀铜板后的混合液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤(写出试剂和操作)①_____________;②____;③过滤弃去滤渣。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
提供的药品:Cl2、浓硫酸、NaOH溶液、CuO、Cu | ||
【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |